
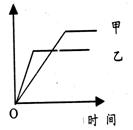
| | 反应 | 纵坐标 | 甲 | 乙 |
| A | 等质量钾、钠分别与水反应 | H 2质量 | 钠 | 钾 |
| B | 相同质量氨,在同一容器中 2NH3 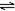 N2+3H2 N2+3H2 | 氨气的转化率 | 500℃ | 400℃ |
| C | 体积比1:3的N2,H2,在体积可变的恒压容器中,2NH3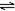 N2+3H2 N2+3H2 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2 mol S02与l mol 02,在相同温度下2S02+02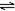 2S03 2S03 | S03物质的量 | 10atm | 2atm |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 zC(气),达到平衡时测得A气体的浓度为0.5 mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol/L,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol/L,则下列叙述正确的是| A.x+y<z | B.平衡向右移动 |
| C.B的转化率升高 | D.C的体积分数降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(g),已知加入1molA和3molB且达到平衡后,生成amolC。达到平衡后C在反应混和物中的百分含量是
3C(g),已知加入1molA和3molB且达到平衡后,生成amolC。达到平衡后C在反应混和物中的百分含量是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| K | 3.84×10-31 | 0.1 | 5×108 | 200 |
 氮的另一途径为 。
氮的另一途径为 。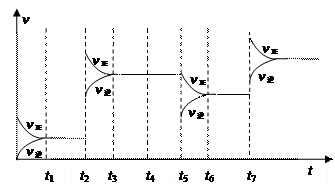
 高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2
高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2 2NH3。有关说法正确的是 。
2NH3。有关说法正确的是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H<0
2NH3(g);△H<0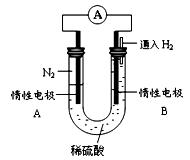
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2O4(g),其化学平衡常K的数学表达式为
N2O4(g),其化学平衡常K的数学表达式为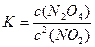 ,式中c2(NO2)表示的意义是 。
,式中c2(NO2)表示的意义是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
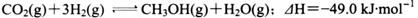
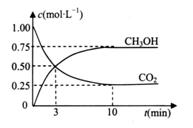
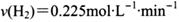
 . 若保持温度不变,
. 若保持温度不变, 向该容器中再充入1mol CO2和3molH2,平衡时
向该容器中再充入1mol CO2和3molH2,平衡时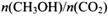 减小
减小查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200mol·L-1、c(C)=0 mol·L-1. 在三种条件下,反应物A的浓度随时间的变化如右图所示。
C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200mol·L-1、c(C)=0 mol·L-1. 在三种条件下,反应物A的浓度随时间的变化如右图所示。
 C的△H>0
C的△H>0查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com