
| A. | 某物质的溶液 pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH 和 Kw 均减小 | |
| C. | pH=5.6 的 CH3COOH 与 CH3COONa 混合溶液中,c(Na+)>c(CH3COO-) | |
| D. | pH=4.5 的番茄汁中 c(H+)是 pH=6.5 的牛奶中 c(H +)的 100 倍 |
分析 A.常温下溶液的pH<7,呈酸性,可能为酸、强酸弱碱盐,也可能为酸式盐,如硫酸氢钠;
B.温度不变,稀释后水的离子积不变;
C.该溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒判断;
D.根据pH=-lgc(H+)计算两溶液中氢离子浓度之比.
解答 解:A.某物质的溶液pH<7,呈酸性,该物质可能是酸或强酸弱碱盐,也可能为酸式盐,如亚硫酸氢钠、硫酸氢钠等,故A错误;
B.Na2CO3溶液加水稀释后,恢复至原温度,碳酸根离子浓度减小,则溶液的pH减小,但是温度不变,水的离子积Kw不变,故B错误;
C.pH=5.6的CH3COOH 与 CH3COONa 混合溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<c(CH3COO-),故C错误;
D.pH=4.5 的番茄汁中c(H+)=10-4.5mol/L,pH=6.5的牛奶中 c(H +)=10-6.5mol/L,则前者溶液中氢离子浓度为后者的100倍,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、溶液酸碱性与溶液pH的计算、离子浓度比较等知识,注意掌握溶液pH的概念及表达式,明确电荷守恒的含义及应用方法.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 氨水浓度/(mol•L-1) | 盐酸浓度/(mol•L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 77 | B. | 95 | C. | 172 | D. | 249 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H3PO4<H2SO4 | B. | 金属性强弱:K<Na | ||
| C. | 碱性强弱:NaOH<Mg(OH)2 | D. | 原子半径:Cl>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
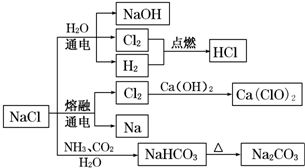
| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | NaHCO3 受热分解的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | 电解饱和氯化钠溶液的方程式为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,氧气发生氧化反应 | |
| B. | 电池正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池负极的电极反应为:2C8H18+50 O2-═16CO2+18H2O+100 e- | |
| D. | 若消耗的O2为11.2 L (标准状况),则电池中有1 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com