
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
分析 (1)①配制准确浓度的草酸溶液,所需要的实验仪器主要有托盘天平(含砝码)、烧杯、药匙、250mL容量瓶、胶头滴管、玻璃棒等;
(2)①根据量取液体的精确度选择仪器;
②高锰酸钾具有强氧化性,可氧化盐酸生成氯气,硝酸能氧化H2C2O4,可应用硫酸酸化;
③H2C2O4反应中C由+3价升高为二氧化碳中+4价,MnO4 -中Mn由+7价降为Mn2+中的+2价,依据氧化还原反应得失电子守恒结合原子个数守恒书写方程式;
④草酸反应完毕,加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色,说明滴定达到终点;
(3)①根据滴定管的结构和精确度;
②先分析数据的有效性,依据滴定管读数读出消耗溶液最后的体积,求出消耗酸性KMnO4溶液的平均体积,然后根据关系式:5H2C2O4~2MnO4-求出H2C2O4的物质的量和质量,再计算草酸晶体的纯度;
(4)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)①配制准确浓度的草酸溶液,所需要的实验仪器主要有托盘天平(含砝码)、烧杯、药匙、250mL容量瓶、胶头滴管、玻璃棒等,所以此操作过程必须用到的2种定量仪器是托盘天平、250mL容量瓶;
故答案为:托盘天平、250mL容量瓶;
(2)①量取25.00mL草酸溶液,精确度为0.01mL,可以使用25mL酸式滴定管(或25mL移液管);
故答案为:25mL酸式滴定管(或25mL移液管);
②高锰酸钾具有强氧化性,可氧化盐酸生成氯气,硝酸能氧化H2C2O4,酸化KMnO4溶液的酸应为稀硫酸;
故答案为:稀硫酸;
③H2C2O4反应中C由+3价升高为二氧化碳中+4价,MnO4 -中Mn由+7价降为Mn2+中的+2价,要使氧化剂与还原剂得失电子相等则H2C2O4系数为5,MnO4 -系数为2,结合原子个数守恒,反应方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
故答案为:2 5 6 2 10 8;
④草酸反应完毕,加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色,说明滴定达到终点;
故答案为:加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色;
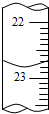
(3)①滴定时的滴定管中的液面,其读数为22.80mL;
故答案为:22.80;
②三次消耗酸性KMnO4溶液体积分别为:20.38mL、20.40mL、20.42mL,三次滴定数据都是有效的,三次消耗盐酸的平均体积为20.40mL,
根据关系式5H2C2O4~2MnO4-可知,n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=$\frac{5}{2}$×0.2000 mol/L×0.0204mL=0.0102mol,
所以25.00mL待测溶液含有:m(H2C2O4•2H2O)═n•M═0.0102mol×126g/mol=1.2852g,
所以250.00 mL待测溶液含有m(H2C2O4•2H2O)═1.2852g×$\frac{250}{25}$=12.852g,
草酸晶体的纯度ω(H2C2O4•2H2O)=$\frac{12.852g}{13.0g}$×100%=98.86%;
故答案为:98.86%.
(4)A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘,因称量时不需要用游码,则无影响,若需要用游码,则药品质量会偏低,故A错误;
B.锥形瓶水洗后未用草酸溶液润洗,草酸的物质的量不变,对实验无影响,故B错误;
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,测定结果偏低,故C正确;
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,使测定结果偏高,故D错误;
故选C.
点评 本题考查氧化还原滴定原理与应用,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
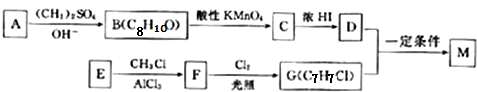
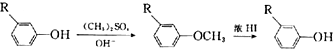
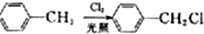
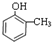 ;E→F的反应类型为取代反应.
;E→F的反应类型为取代反应.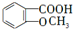 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$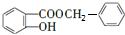 +HCl
+HCl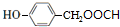 (写结构简式).
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备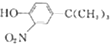 的合成路线:
的合成路线: $→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$
$→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$ $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$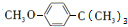 $→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$
$→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$ $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$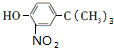 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①→②→③→④ | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→④→②→③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HPO32-既能电离也能水解 | |
| B. | Na2HPO3溶液一定呈碱性 | |
| C. | H3PO3具有还原性 | |
| D. | H3PO3的溶液中加入过量NaOH,生成Na3PO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
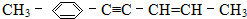 ,共面的碳原子最多有
,共面的碳原子最多有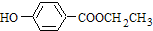 ;
;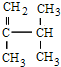 系统法命名的名称为2,3-二甲基-1-丁烯.
系统法命名的名称为2,3-二甲基-1-丁烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
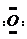 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com