
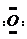 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.分析 (1)原子晶的沸点高于分子晶体;24g金刚石物质的量为2mol,每1mol碳原子和4mol碳原子形成共价键,则1mol碳原子形成的共价键为:1mol×4×$\frac{1}{2}$=2mol,所以2mol金刚石含有碳碳键的个数为4NA;
(2)氧化镁的电子式为Mg2+[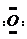
(3)若起始时向容器中加入1mol CO2,5.0min后,容器内气体的相对平均分子量为32,说明变化的氧原子质量为8g,变化的二氧化碳的物质的量为0.25mol,根据速率的计算公式计算;
(4)当变量不变时平衡,根据平衡移动的影响因素分析;
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动,但到达新平衡时的效果与原平衡等效,故二氧化碳的转化率不变,CO的物质的量增大.
解答 解:(1)金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力,故熔点金刚石大于石墨烯;24g金刚石物质的量为2mol,每1mol碳原子和4mol碳原子形成共价键,则1mol碳原子形成的共价键为:1mol×4×$\frac{1}{2}$=2mol,所以2mol金刚石含有碳碳键的个数为4NA,故答案为:金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力;4NA;
(2)氧化镁的电子式为Mg2+[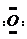
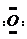
(3)若起始时向容器中加入1mol CO2,5.0min后,容器内气体的相对平均分子量为32,说明变化的氧原子质量为8g,变化的二氧化碳的物质的量为0.25mol,根据速率的计算公式知,ν(CO2)=$\frac{\frac{0.25}{2}}{5}$=0.025mol/(L•min);
(4)一定条件下,在容积恒为2.0L的容器中,CO2(g)+Fe(s)?FeO(s)+CO(g),
a.当混合气体的密度是变量,不变时说明反应达到了平衡,故正确;
b.混合气体的平均相对分子质量是变量,不变时说明反应达到了平衡,故正确;
c.平衡后移除二氧化碳时,正反应速率先减小后增大,直至建立新的平衡,故错误;
d.平衡后缩小容器的体积,正逆反应速率增大,但平衡不移动,故错误;
故答案为:cd;
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动,但到达新平衡时的效果与原平衡等效,故二氧化碳的转化率不变,CO的物质的量增大,故答案为:正向;不变;增大.
点评 本题考查了电子式、结构式、熔沸点高低比较、化学反应速率、化学平衡等知识,属于综合性题型,解题时要细心,避免书写的错误,难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| C. | 氢气之所以被称为“绿色能源”是因为它燃烧的产物不会污染环境 | |
| D. | 人类利用的能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g乙酸与甲酸甲酯的混合物中含有氧原子数目为0.2NA | |
| B. | 苯与液溴反应生成1mol溴苯分子,消耗0.5NA个Br2 | |
| C. | 常温常压下,等质量的N2H4和CH3OH含有相同数目的原子 | |
| D. | 6gSiO2晶体中含有0.4NA个Si-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
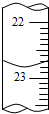 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
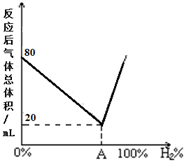 ①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.
①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
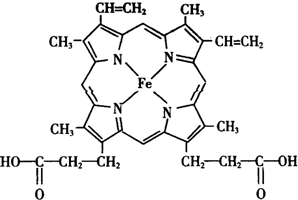 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: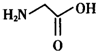 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.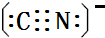 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
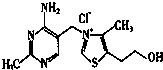 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
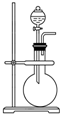 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com