
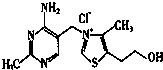
 请回答下列问题:
请回答下列问题:分析 (1)Ga原子核外电子数为31,根据能量最低原理书写核外电子排布式;Ga是第ⅢA族的金属元素、As是第ⅤA族的非金属元素,二者组成的化合物化学式为GaAs,对应晶体属于原子晶体;
(2)由结构简式知,B1中含有氯离子及另一种有机离子,存在离子键,B1是分子型物质,熔点不可能高于NaCl,同种元素原子之间形成非极性键,不同元素原子之间形成非极性键;
(3)晶体溶于水的过程会电离出Cl-等,故需要克服离子键,B1分子间存在氢键,存在范德华力.
解答 解:(1)Ga原子核外电子数为31,核外电子排布式为:1s22s22p63s23p63d104s24p1,Ga是第ⅢA族的金属元素、As是第ⅤA族的非金属元素,二者组成的化合物化学式为GaAs,对应晶体属于原子晶体,
故答案为:1s22s22p63s23p63d104s24p1;GaAs;原子晶体;
(2)a.由结构简式知,B1中含有氯离子及另一种有机离子,存在离子键,故a错误;
b.B1中含有氯离子及另一种有机离子,存在离子键,其它原子之间形成共价键,故b正确;
c.B1是分子型物质,熔点不可能高于NaCl,故c错误;
d.碳原子之间形成非金属性,N原子与H原子等之间形成极性键,故d正确,
故选:cd;
(3)晶体溶于水的过程会电离出Cl-等,故需要克服离子键,B1分子间存在氢键,存在范德华力,
故选:d.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | ①→②→③→④ | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→④→②→③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
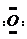 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
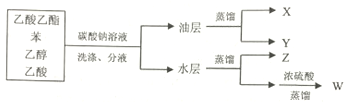
| A. | X是最简单的芳香烃,分子中含有三个碳碳双键 | |
| B. | Y是具有芳香气味的液体,难溶于水,易溶于有机溶剂,能发生水解反应 | |
| C. | Z是无色,有特殊香味的液体,与硫酸混合在140℃可以制备乙烯 | |
| D. | W是有强烈刺激性气味的无色液体,可与氢气发生加成反应,生成Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮在自然界中广泛存在.
碳、氮在自然界中广泛存在.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


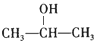 +NaCl;
+NaCl;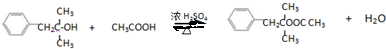 ;
;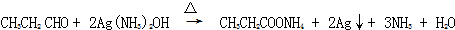 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
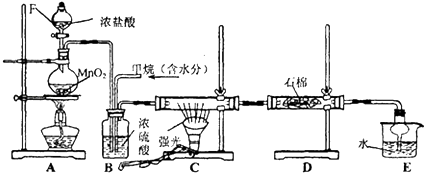
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
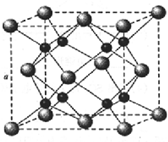 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com