
 其中含有的化学键的类型离子键、共价键
其中含有的化学键的类型离子键、共价键分析 A、B、C、D、E、F、G七种元素为元素周期表中短周期元素,其原子序数依次增大.A的质量数等于其质子数,说明原子核内无中子,应为H元素;B原子的最外层电子数是其电子层数的2倍,为C元素;D的最外层电子数是其电子层数的3倍,为O元素,则C为N元素;E、F、G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,则F为Al,E为Na,E、F、G的最外层电子数之和为10,可知G的最外层电子数为10-1-3=6,为S元素,以此解答该题.
解答 解:A、B、C、D、E、F、G七种元素为元素周期表中短周期元素,其原子序数依次增大.A的质量数等于其质子数,说明原子核内无中子,应为H元素;B原子的最外层电子数是其电子层数的2倍,为C元素;D的最外层电子数是其电子层数的3倍,为O元素,则C为N元素;E、F、G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,则F为Al,E为Na,E、F、G的最外层电子数之和为10,可知G的最外层电子数为10-1-3=6,为S元素,
(1)由以上分析可知D为氧元素,F为铝元素,故答案为:氧;铝;
(2)C为N元素,位于周期表第二周期ⅤA族,故答案为:第二周期ⅤA族;
(3)D,E两元素形成的1:1的化合物为过氧化钠,为离子化合物,含有离子键和共价键,形成过程为 ,
,
故答案为: ;离子键、共价键;
;离子键、共价键;
(4)由A、D、E、G四种元素组成的两种盐为NaHSO4、NaHSO3,二者反应生成二氧化硫和水,反应的化学方程式为NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑,
故答案为:NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑;
(5)氢氧化铝具有两性,能与氢氧化钠反应生成偏铝酸钠,离子反应方程式为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O.
点评 本题考查了元素位置结构性质的相互关系及应用,为高考常见题型,根据原子结构、元素周期表结构确定元素,再结合物质的性质来分析解答,正确推断元素是解本题关键根据,题目难度中等.


科目:高中化学 来源: 题型:填空题
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲组 | c(HA)=0.2mol/L | c(NaOH)=0.2mol/L | pH=a |
| 乙组 | c(HA)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丙组 | pH=2 | pH=12 | pH=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表里属于过渡元素的化合物 | |
| B. | 位于元素周期表里第ⅡA族元素的化合物 | |
| C. | 位于元素周期表里第ⅢA族元素的化合物 | |
| D. | 位于元素周期表里第ⅣA族元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数2NA | |
| B. | 标准状况下,含NA个共价键的HF分子所占的体积约为22.4 L | |
| C. | 1mol Fe 与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA | |
| D. | 2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
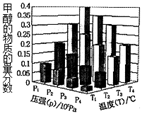 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T1>T3 | D. | P1>P4 T2<T3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物不能发生加成反应,但能发生取代反应 | |
| B. | 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 | |
| C. | 该有机物分子中的所有原子可能在同一平面上 | |
| D. | 该有机物的一溴代物最多有11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.
营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY | |
| B. | 若a=b,并测得溶液中c(X-)=c(Y-)+c(HY)(c(HY)≠0),则相同浓度时,酸性HX>HY | |
| C. | 若a>b,并测得溶液中c(HX)=c(HY),则可推出溶液中c(X-)>c(Y-),且相同浓度时,酸性HX>HY | |
| D. | 若两溶液等体积混合,测得溶液中c(X-)+c(Y-)+c(HX)+c(HY)=0.1 mol/L,则可推出a+b=0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
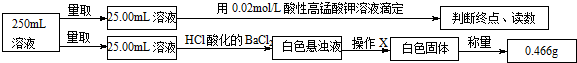
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com