
【题目】下列物质的性质比较,正确的是( )
A. 酸性:H2SO4>HClO4>HBrO4 B. 碱性:NaOH>KOH>RbOH
C. 非金属性:P>S>Cl D. 气态氢化物稳定性:HF>HCl>H2S
科目:高中化学 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电于数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
(1)B在元素期表中的位置为_______,1个C原子核外有____个未成对的电子。
(2)D、E、F三种元素形成简单离子其半径由l大到小的顺序是_____________。(用离子符号表示)。
(3)写出D与C形成化合物的电子式______、_______。
(4)常温下,1molA的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为______________。
(5)非金属性的强弱:E_____F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因________________。
(6)Na2SO3可用作漂白织物时的去鼠剂。Na2SO3溶液及收Cl2后,溶液的酸性增强。写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中能说明2HI(g)![]() H2(g)+I2(g)已达平衡状态的是__________。
H2(g)+I2(g)已达平衡状态的是__________。
(1)单位时间内生成nmol H2的同时生成nmolHI;
(2)一个H-H键断裂的同时有两个H-I键断裂;
(3)c(HI)=c(I2);
(4)反应速率:v(H2)=v(I2)=![]() v(HI);
v(HI);
(5)c(HI)∶c(I2)∶c(H2)=2∶1∶1;
(6)温度和体积一定时,某一生成物浓度不再变化;
(7)温度和体积一定时,容器内压强不再变化;
(8)条件一定,混合气体的平均相对分子质量不再变化;
(9)温度和体积一定时,混合气体的颜色不再发生变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是( )
|
|
|
|
A.氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰(甲烷水合物),将其作为能源使用 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
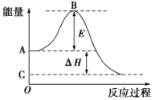
(1)图中A点表示:________________________________________;C点表示:________________。E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-Q1
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-Q2
O2(g)===H2O(g) ΔH2=-Q2
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-Q3
O2(g)===H2O(l) ΔH3=-Q3
常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为
A. 0.4Q1+0.05Q2 B. 0.4Q1+0.1Q2
C. 0.4Q1+0.05Q3 D. 0.4Q1+0.1Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列观点正确的是( )
A. 化合物电离时,生成的阴离子是氢氧根离子的是碱
B. 某化合物的熔融状态能导电,该化合物中一定有离子键
C. 某化合物的水溶液能导电,该化合物可能是非电解质
D. 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com