
【化学选修5有机化学基础】(15分)物质A有如下转化:

(1)A的分子式为 ,F的结构简式为 .。
(2)A→C的化学方程式为_______________________________,反应类型为__________。
(3)B的同分异构体中能与浓溴水反应,满足条件:①1 mol物质最多能消耗3 mol Br2②苯环上只有两个取代基③分子中只出现一个—CH3的结构有____________种。
(4)已知在一定条件下R1CH===CHR2―→R1CHO+R2CHO,A在一定条件下氧化生成X、Y(A中酚羟基已被保护),X的分子式为C7H6O2,它是芳香族化合物,Y可进一步氧化得到一种还原性的二元羧酸。
①写出两类含有醛基X的同分异构体____________,____________。
②Y与乙二醇发生酯化反应形成高分子化合物的化学方程式为___________。
(1)C9H8O2 (2分)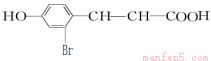
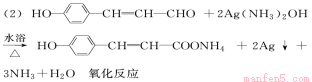
(方程式2分,类型1分)
(3)3(2分)
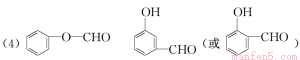 (各2分)
(各2分)
(5)(2分)nHOOC-COOH+nHOCH2CH2OH 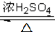 HO-[-OCCOOCH2CH2O-]- n H +(2n-1)H2O
HO-[-OCCOOCH2CH2O-]- n H +(2n-1)H2O
【解析】
试题分析:(1)A为对羟基苯丙烯醛,分子式为C9H8O2, F的结构简式见答案;(2)A→C的反应为醛基被氧化为羧基,化学方程式见答案,反应类型为氧化反应。(3)B 为HOCH2CH2CH2—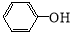 ,其同分异构体中能与浓溴水反应属于酚类,①1 mol物质最多能消耗3 mol Br2,羟基邻、对位上有3个氢原子,②苯环上只有两个取代基处于间位③分子中只出现一个—CH3的结构有3种。(CH3CHOHCH2—、CH3CH2CHOH—和CH3C(CH2OH)—分别连酚羟基的间位)(4)根据题给信息,对羟基苯丙烯醛在一定条件下氧化生成X、Y(A中酚羟基已被保护),X的分子式为C7H6O2,它是芳香族化合物,则X为对羟基苯甲醛,Y为乙二醛,可进一步氧化得到一种还原性的二元羧酸乙二酸。①两类含有醛基X的同分异构体为苯氧甲醛和间羟基苯甲醛,结构简式见答案。②乙二酸与乙二醇发生酯化反应形成高分子化合物的化学方程式为
,其同分异构体中能与浓溴水反应属于酚类,①1 mol物质最多能消耗3 mol Br2,羟基邻、对位上有3个氢原子,②苯环上只有两个取代基处于间位③分子中只出现一个—CH3的结构有3种。(CH3CHOHCH2—、CH3CH2CHOH—和CH3C(CH2OH)—分别连酚羟基的间位)(4)根据题给信息,对羟基苯丙烯醛在一定条件下氧化生成X、Y(A中酚羟基已被保护),X的分子式为C7H6O2,它是芳香族化合物,则X为对羟基苯甲醛,Y为乙二醛,可进一步氧化得到一种还原性的二元羧酸乙二酸。①两类含有醛基X的同分异构体为苯氧甲醛和间羟基苯甲醛,结构简式见答案。②乙二酸与乙二醇发生酯化反应形成高分子化合物的化学方程式为
nHOOC-COOH+nHOCH2CH2OH 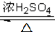 HO-[-OCCOOCH2CH2O-]- n H +(2n-1)H2O 。
HO-[-OCCOOCH2CH2O-]- n H +(2n-1)H2O 。
考点:考查有机合成和有机推断,涉及反应类型的判断、同分异构体和化学方程式的书写。
考点分析: 考点1:有机化学知识综合应用 试题属性

科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.安装煤炭“固硫”装置,降低酸雨发生率
B.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
C.研发易降解的塑料,防止白色污染
D.氮的固定只有在高温、高压、催化剂的条件下才能实现
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:选择题
【原创】设NA为阿伏加德罗常数的值。下列说法正确的是
A.3.5mol/L的NaNO2溶液含有NO2-数目为3.5NA
B.标准状况下,0.672L CO2分子中共价键数目为0.12 NA
C.1 L 0.1 mol·L-1NH4HCO3溶液中HCO3-数目为0.1 NA
D.4.8gCH3OH含有-OH数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省盟校高三第一次十校联考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。
该原子核外电子排布式是 。
其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体
1mol该化合物含有的化学键数为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个δ键, 个л键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省盟校高三第一次十校联考理综化学试卷(解析版) 题型:选择题
下列实验装置能达到相关实验目的的是
A.图1可用于分离收集CO和CO2
B.图2用于从食盐水中提取NaCl晶体
C.图3用于收集NO
D.图4用于氢氧化铁胶体和硫酸钠溶液的分离
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省红色六校高三第二次联考理综化学试卷(解析版) 题型:填空题
(15分)(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 = 6CaSiO3+P4O10 10C+P4O10 = P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有 。
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
①P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
②P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为 ,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为 。
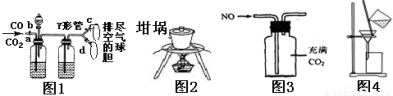
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料。一容器被离子交换膜分成左右两部分,如图所示。

若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象: ;若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 。
(Ⅲ)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用。通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b。(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃。)
(1)若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,
化学反应方程式为 _________。
(2)若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有 _________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省红色六校高三第二次联考理综化学试卷(解析版) 题型:选择题
近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性。下列有关说法正确的是
A.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
B.高锰酸钾溶液和双氧水的消毒原理相同
C.双氧水具有较强的腐蚀性,不能用于皮肤的消毒
D.在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:实验题
(15分)草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是 。
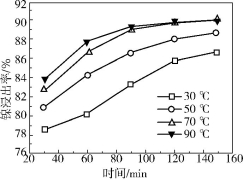
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为 (填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是 。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是 。
②烘干温度不超过110℃的原因是 。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”, ,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步: ,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三一模考试理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol Zn与足量任意浓度的硫酸反应转移电子数均是2 NA
B.在常温常压下1 mol C7H16中含有共价键的总数目是23 NA
C.0.1 mol FeCl3完全水解生成Fe(OH)3胶体粒子数目为0.1NA
D.33.6 L 盐酸在标准状况下所含有HCl分子的数目为1.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com