
 2NH3(g)(正反应为放热反应),下列说法中正确的是( )。
2NH3(g)(正反应为放热反应),下列说法中正确的是( )。| A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡也大 |
| B.达到平衡后,升高温度,既加快了正、逆反应的速率,又提高了NH3的产率 |
| C.达到平衡后,缩小容器的体积,既有利于加快正、逆反应速率,又有利于提高氢气的转化率 |
| D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,逆反应速率减小 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题

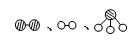 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。| | 注意事项 | 理由 |
| ① | | |
| ② | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.②③④ | C.①②③ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KH2PO4和NH4Cl | B.NH4Cl和NH4NO3 |
| C.KNO3和KH2PO4 | D.NH4Cl和KNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有①② | B.只有①③④ | C.只有①②③ | D.全部 |
查看答案和解析>>
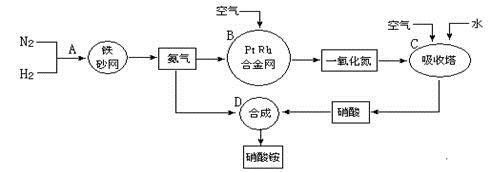
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com