
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+ 3H2(g) ![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2 s末浓度/mol·L-1 0.6 1.8 1.0
4 s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2 s末氨气的反应速率为0.4 mol·L-1·s-1
B.前2 s时间内氨气的平均反应速率为0.4 mol·L-1·s-1
C.前4 s时间内氨气的平均反应速率为0.3 mol·L-1·s-1
D.2~4 s时间内氨气的平均反应速率为0.2 mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中U→Z六种物质在适当条件下能实现图示箭头方向一步转化,且反应①、②均为置换反应,满足条件的物质组是( )
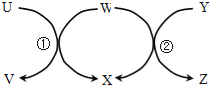
序号 | U | W | Y | X |
① | Na | H2O | Na2O2 | NaOH |
② | Fe | H2O | C | H2 |
③ | HBr | Cl2 | CH4 | HCl |
④ | CuCl2(aq) | Al | HCl(aq) | AlCl3(aq) |
A.②④ B.②③ C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______________.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,请配平该反应的离子方程式:
______MnO4﹣+______ H2C2O4+______ H+═______ Mn2++______ CO2↑+______ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红色.据此回答:
上述装置中,D的作用是_________.乙二酸分解的化学方程式为_________.只根据G中澄清石灰水变浑浊能否得出“草酸分解产物中一定有CO”的结论_________(填“能或不能”)若不能应怎样改进?______________.
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化).则下列关系合理的是_________
A.c(Na+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣)
B.c(HC2O4﹣)+c(C2O42﹣)=0.2molL﹣1
C.c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D.c(Na+)=c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.806×1022个NH3分子的体积为 ,氢原子的物质的量为 ,溶于水形成200ml溶液所得氨水的物质的量浓度为 。
(2)将7.1g Na2SO4溶于水配成200mL溶液,溶液中Na+的物质的量浓度为__________。向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.6mol·L-1(假设溶液体积不变)需加入NaCl的质量为__________。
(3)有FeCl2、CuCl2混合溶液400 mL,经测定其中Cl- 浓度是a mol / L。投入过量的锌粉b g,充分反应后过滤,所得固体残渣洗涤干燥后,质量为c g。则原混合溶液中Fe2+是_________ mol / L,Cu2+是_________mol / L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的主要玻璃仪器有烧杯、玻璃棒、________________________。
(2)若对调B和C装置的位置,________(填“能”或 “不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1 H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是__________________________________________。
②若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案:使用下图装置,加热15.0 mL 饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是______________________________________。
(不考虑实验装置及操作失误导致不可行的原因)

(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节): ______________。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.福尔马林可用于保存海鲜产品
B.鸡蛋清中加入CuSO4溶液会发生变性
C.合成橡胶与光导纤维都属于有机高分子材料
D.丝绸和棉花的组成元素相同,分子结构不同,因而性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.4g水与_ ___g硫酸所含的分子数相等,它们所含氧原子数之比是_ ___ ,其中氢原子数之比是_ ___ 。若将上述硫酸配成500mL溶液,所得溶液的溶质的物质的量浓度为_ ___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D
(1)B元素的原子最外层电子数与A相同,则B在元素周期中的位置___ __.
(2)写出易与C发生反应的酸与C反应的化学方程式是______________.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E:将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出生成D的化学反应方程式:______________.
②要将纯碱高温熔化,下列坩埚中不可选用的是__________.
A.普通玻璃坩埚 | B.石英玻璃坩埚 | C.铁坩埚 | D.瓷坩埚. |
③将过量的E通入D的溶液中发生反应的离子方程式是:_________________。
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com