
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______________.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,请配平该反应的离子方程式:
______MnO4﹣+______ H2C2O4+______ H+═______ Mn2++______ CO2↑+______ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红色.据此回答:
上述装置中,D的作用是_________.乙二酸分解的化学方程式为_________.只根据G中澄清石灰水变浑浊能否得出“草酸分解产物中一定有CO”的结论_________(填“能或不能”)若不能应怎样改进?______________.
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化).则下列关系合理的是_________
A.c(Na+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣)
B.c(HC2O4﹣)+c(C2O42﹣)=0.2molL﹣1
C.c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D.c(Na+)=c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)
【答案】(1)HCO3﹣+H2C2O4=HC2O4﹣+CO2↑+H2O
(2)2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
(3)除去混合气体中的CO2, H2C2O4![]() H2O+CO↑+CO2↑
H2O+CO↑+CO2↑
不能,在D、E之间增加一个装有澄清石灰水的洗气瓶 (4)CD
【解析】
试题分析:(1)由于草酸的酸性强于碳酸,且加入了足量的草酸,所以加入草酸后发生反应草酸转化为HC2O4-,根据复分解反应的规律,强酸制取弱酸,反应的离子方程式是:HCO3 - +H2C2O4 =HC2O4 - +CO2↑+H2O;
(2)①向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4 溶液,振荡,发现其溶液的紫红色褪去,说明具有氧化性的高锰酸钾被还原,说明草酸具有还原性,把MnO4 - 还原为Mn2+ ;反应中根据氧化剂得到电子与还原剂失去电子相等,可知氧化剂和还原剂物质的量之间的关系为:2 MnO4 - -~5H2C2O4,再根据电荷守恒和质量守恒可写出反应方程式为:2MnO4 - +5H2C2O4 +6H+ =2Mn2+ +10CO2 ↑+8H2O;
(3)将一定量的乙二酸放于试管中,然后加热,实验发现:装置C、G中澄清石灰水变浑浊,证明反应产生CO2;B中CuSO4粉末变蓝,证明产生了H2O;F中CuO粉末变红,说明产生了还原性的气体,该气体反应后可以使澄清石灰水变浑浊,证明有CO产生,因此乙二酸分解的化学方程式为H2C2O4![]() H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4 固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成;由于不能确定前面的CO2是否被除尽,所以只根据G中澄清石灰水变浑浊不能得出“草酸分解产物中一定有CO”的结论,需要在D、E之间增加一个装有澄清石灰水的洗气瓶。
H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4 固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成;由于不能确定前面的CO2是否被除尽,所以只根据G中澄清石灰水变浑浊不能得出“草酸分解产物中一定有CO”的结论,需要在D、E之间增加一个装有澄清石灰水的洗气瓶。
(4)两者的物质的量的比是1:1,反应生成NaHC2 O4 ,溶液显酸性说明HC2O4-的电离程度大于其水解程度,A、不符合电荷守恒,应该是c(Na + ) + c(H + ) = c(HC2O4﹣) + c(OH﹣) + 2c(C2O42﹣),A错误;B、不满足物料守恒,应该是c(Na + ) = c(H2C2O4) + c(HC2O4﹣) + c(C2O42﹣)=0.2mol/L,B错误;C、溶液中还存在着水的电离,故c(H + ) > c(C2O42-),由于离子的电离程度较小,则有c(HC2O4-) > c(H + ),而Na + 不发生任何反应,所以c(Na + ) > c(HC2O4-),因此溶液中各离子的浓度由大到小的顺序为c(Na + ) > c(HC2O4-) > c(H + ) > c(C2O42-) > c(OH-),C正确;D、根据B中分析可知D正确,答案选CD。


科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品﹣3PbOPbSO4H2O (三盐),主要制备流程如下:
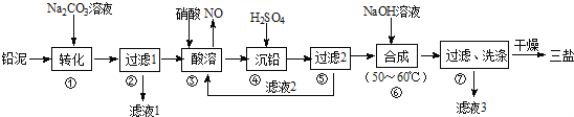
(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为______________.
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为______________(写化学式).
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为______________;滤液2中溶质主要成分为______________(写化学式).
(4)步骤⑥合成三盐的化学方程式为______________.
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中一定能大量共存的是
A. 使pH试纸呈蓝色溶液中:I-、Cl-、NO3-、Cu2+
B. 使酚酞呈深红色的溶液中:Na+、Cl-、H+、NO3-
C. 含大量Ag+的溶液中:K+、Na+、NO3-、SO42-
D. 含大量OH-的溶液中:CO32-、Cl-、F-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl一由正极向负极迁移
D.负极会发生副反应 Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质.

(1)步骤1的主要操作需用到的玻璃仪器除烧杯外有 .
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,固体残渣的成分是 (填化学式)
(3)步骤3中涉及的操作是: 、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+ 3H2(g) ![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2 s末浓度/mol·L-1 0.6 1.8 1.0
4 s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2 s末氨气的反应速率为0.4 mol·L-1·s-1
B.前2 s时间内氨气的平均反应速率为0.4 mol·L-1·s-1
C.前4 s时间内氨气的平均反应速率为0.3 mol·L-1·s-1
D.2~4 s时间内氨气的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
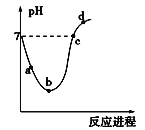
A.a点所示的溶液中[H+]=[Cl-]+[HClO]+[OH-]
B.b点所示的溶液中[H+]>[Cl-]>[HClO]>[ClO-]
C.c点所示的溶液中[Na+]=[HClO]+[ClO-]
D.d点所示的溶液中[Na+]>[ClO-]>[Cl-]>[HClO]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com