
【题目】如表所示是元素周期表示意图的一部分,根据表中10种元素,用元素符号或化学式填空。
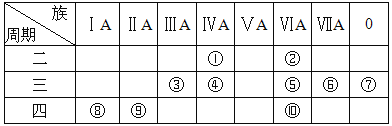
(1)①~⑩元素中,金属性最强的是 (填元素符号);化学性质最不活泼的是 (填元素符号)。
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是 (填元素符号),该水化物与NaOH溶液反应的离子方程式为 。
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的是 (填化学式),碱性最强的是 (填化学式)。
(4)⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是 。(填离子符号)
【答案】(1)K Ar (2) Al Al(OH)3+OH—=AlO2—+2H2O(3)HClO4KOH (4)S2— >Cl— >K+ >Ca2+
【解析】试题分析:由元素在周期表中位置,可知①为C、②为O、③为Al、④为Si、⑤为S、⑥为Cl、⑦为Ar、⑧为K、⑨为Ca、⑩为Se,则
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中K元素金属性最强,稀有气体Ar的化学性质最不活泼;
(2)最高价氧化物对应的水化物呈两性的元素是Al,氢氧化铝是两性氢氧化物,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为Al(OH)3+OH—=AlO2—+2H2O;
(3)上述元素中,氯元素的最高价氧化物的水化物高氯酸的酸性最强,化学式为HClO4,上述元素中K元素金属性最强,故碱性最强的为KOH;
(4)电子层结构相同,核电荷数越大离子半径越小,故离子半径)S2— >Cl— >K+ >Ca2+。


科目:高中化学 来源: 题型:
【题目】下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。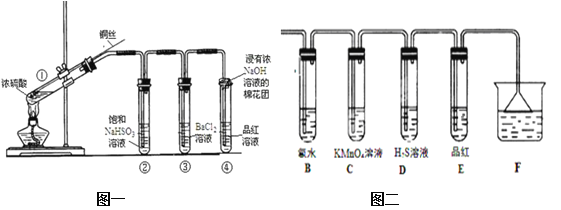
(1)①中反应的化学方程式是 。其中铜发生了 (填“氧化”或“还原”)反应,判断依据为 _______________ 。
(2)浓硫酸在此反应中体现了_________性和____________性。
(3)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是 _____________。
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(4)反应停止后,待装置冷却,向③中溶液加入NaOH溶液,观察到的现象是__________。
(5)④中棉花团的作用是 ____ 。
(6)若将浓硫酸与铜反应后产生的气体通入图二的装置中则反应后,装置B中发生的现象是 ,反应的化学方程式为 ______________________;装置C中的现象是 ,表现了SO2的 性;装置D中现象是 ,表现了SO2的 性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)![]() 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(I2)= 。
(2)2min未c(HI)= mol/L。
(3)起始时,c(H2)= mol/L,反应进行到2min时,容器中I2所占的体积分数是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5mol/L,可认为该离子不存在)。下列说法不正确的是

A.某温度下,CO2饱和溶液的浓度是0.05 molL-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1mol/LNa2CO3中c(HCO3﹣)比0.1mol/LH2CO3中c(HCO3﹣)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的化学方程式为________________________________________。
(2)装置A的烧瓶中可装的试剂为___________________。
(3)E装置的作用______________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________________________________________________。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为_______________mol-1(用含a、b的代数式表示)。
从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,实验室常用烧碱溶液吸收Cl2。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为8︰1时,混合液中NaClO和NaClO3的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
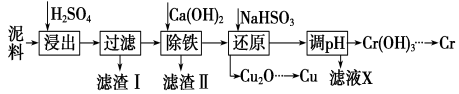
【题目】工业上利用电镀污泥 (主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
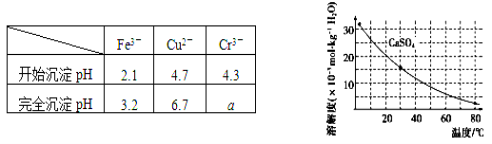
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__________________。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约________,检验Fe3+已经除尽的操作是_________________;
②将浊液加热到80℃,______________________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是_______。
(4)当离子浓度小于或等于1×10-5mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥______。[已知:Ksp[Cr(OH)3]=6.3×10-31,![]() ≈4.0]。
≈4.0]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在298K,100kPa时.CH4的燃烧热是890.0kJ/mol,写出该反应的热化学方程式__________。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,共放出QkJ热量(假定热量未损失),则CH4和CO的物质的量的比为__________。
(2)利用甲烷的燃烧反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液.多孔石墨作电极,在电极上分别通入甲烷和氧气,通入甲烷气体的电极上发生的电极反应是___________,当电路中转移12mol电子时,实际提供的电能是890.0kJ,则该电池的能量转化效率是__________。
(3)将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:

①当开关K1闭合,则铁发生电化学腐蚀中的__________腐蚀。
②当开关K2闭合,则总反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH+SOC12=R-C1+SO2↑+HC1↑,请回答:

(1)写出有关物质的结构简式:A__________、D__________。
(2)指出反应类型:①__________,②__________。
(3)写出下列化学方程式:反应①__________;反应②__________。
(4)二甘醇又名(二)乙二醇醚.根据其结构判断下列说法正确的是__________(填序号)
A.难溶于水B.沸点较高C.不能燃烧D.可与金属钠反应
(5)E的同分异构体很多,指出同时符合下列条件的同分异构体的数目有__________种,
①属于链状结构②羟基不能直接连在不饱和碳原子上
③不含有“O=C=C”或“C=C=C”结构④不考虑各种立体异构
并写出其中能够发生银镜反应的所有异构体的结构简式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小
B.反应前5秒钟内,用CO表示的平均反应速率为0.04 mol·L-1·s-1
C.当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变
D.保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com