
【题目】将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)![]() 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(I2)= 。
(2)2min未c(HI)= mol/L。
(3)起始时,c(H2)= mol/L,反应进行到2min时,容器中I2所占的体积分数是_______________。
【答案】(1)0.05mol/(L·min);(2)0.2;(3)0.5,40%。
【解析】
试题分析:(1)同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(H2)=v(I2)=1/2v(HI)=1/2×0.1mol/L.min=0.05mol/(L·min);(2) 2min未c(HI)=v·t=0.1 mol/(L·min) ×2min =0.2mol/L;(3)碘蒸气的起始浓度=2min末碘蒸气浓度+参加反应的碘蒸气浓度=0.4mol/L +0.05 mol /(L·min)×2min =0.1mol/L+0.4mol/L=0.5mol/L,由于开始时H2和I2(g)物质的量相等,所以开始时氢气的物质的量浓度是0.5mol/L;由于该反应是反应前后气体体积相等的反应,容器的容积不变,所以反应进行到2min时,容器中I2所占的体积分数等于其所占的物质的量浓度的比,是[0.4mol/L÷ (0.5mol/L+ 0.5mol/L)]×100%=40%。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4· 7H2O)俗称绿矾,加热至高温会分解。某化学研究小组利用下列装置探究FeSO4分解后的产物。
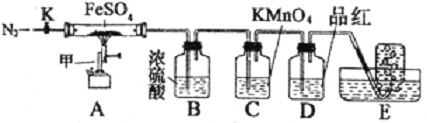
实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取mgFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K。加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃。待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末。请回答下列问题:
(1)仪器甲的名称是__________;
(2)B中浓硫酸的作用__________。
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化。写出C中发生反应的离子方程式__________;
(4) FeSO4完全分解后,还需要通入一段时间N2的原因是__________。
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
Ⅰ、称量B装置在实验前后增重 0.80g;
Ⅱ、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
Ⅲ、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mo1/L标准H2C2O4溶液滴定至终点:
Ⅳ、重复实验3次.记录数据如下:
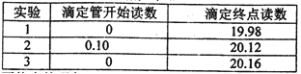
①滴定至终点的现象__________。
②FeSO4分解的化学方程式为__________。
(6)请设计一个实验来检验A中的FeSO4是否完全分解__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是短周期元素的气态单质,其中A是黄绿色的气体单质,C在空气中含量最高,D是最轻的气体;E是一种最常用的金属;Y是一种常见的液态物质,Z是唯一显碱性的气体; M是一种红棕色的有毒气体;I为红褐色难溶于水的固体。有关的转化关系如下图所示(反应条件均已略去)。
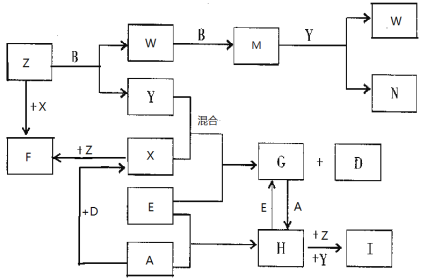
回答下列问题:
(1)A的组成元素在元素周期表的位置为 ;
(2)F中化学键的类型是 、 ;(每空2分,共4分)
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为 ;
(4)I为红褐色难溶于水的固体,与“84消毒液”的有效成分(NaClO) ,在浓碱溶液中发生反应生成了高效环保的净水剂高铁酸钠,请写出此反应的离子方程式 。
(5)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为
g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 和E同主族 |
C | lmo1C单质能与冷水反应,在标准状况下生成11.2LH2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1) A在周期表中的位置为 。
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
A.比较两种单质的颜色
B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置
D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A.催化剂V2O5不改变该反应的逆反应速率
B.恒压,通入稀有气体,反应速率不变
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是C1mol/L,C2 mol/L,则时间间隔t1(s)~t2(s)内,SO3(g)消耗的平均速率为 V=(C2-C1)/(t2-t1) mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表)。其实验步骤为:
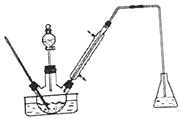
步骤1:将三颈瓶中的一定配比的无水AlCl3, 20mLl, 2 -二氯乙烷和20mL苯甲醛充分混合后.升温至60℃,缓慢滴加经H2SO4干燥过的液溴20mL,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,__________。
步骤3:有机相用10%NaHCO3溶液洗涤。经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是__________,锥形瓶中的溶液应为__________。
(2)步骤1所加入的物质中,AlCl3是催化剂,请推测1, 2-二氯乙烷的作用__________。
(3)有同学建议将装置中温度计换成搅拌器,那么温度计应移到什么地方__________。
(4)步骤2后续操作是__________。
(5)步骤3中用10%的NaHCO3溶液洗涤的具体操作是__________。加入无水MgSO4固体的作用是__________。
(6)步骤4中采用减压蒸馏技术,是为了防止__________。
(7)最后收集到间溴苯甲醛10mL,则该实验的产率为__________。
附表相关物质的沸点(101kPa)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224L HCl气体溶于635mL水中,所得盐酸的密度为1.18gcm-3.试计算:
(1)所得盐酸的物质的量浓度是_________;
(2)取出这种盐酸10mL,稀释至118mL,所得稀盐酸的物质的量浓度是_________。若用量筒取10mL盐酸时仰视,其他操作均正确,则稀盐酸浓度_________(填“偏大”、 “不变”或“偏小”)。
(3)在40.0mL 0.065molL-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_________ mL?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示是元素周期表示意图的一部分,根据表中10种元素,用元素符号或化学式填空。
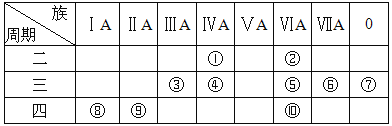
(1)①~⑩元素中,金属性最强的是 (填元素符号);化学性质最不活泼的是 (填元素符号)。
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是 (填元素符号),该水化物与NaOH溶液反应的离子方程式为 。
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的是 (填化学式),碱性最强的是 (填化学式)。
(4)⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是 。(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题。
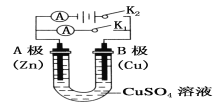
(1)根据上图回答①②:
①打开K2,闭合K1。
A电极可观察到的现象是________________________________;
B极的电极反应式为___________________________________。
②打开K1,闭合K2。
A电极可观察到的现象是__________________________________;
B极的电极反应式为_____________________________________。
(2)根据下图回答③④:
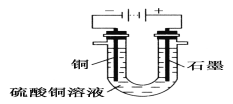
③将较纯净的CuSO4溶液放入上图所示的装置中进行电解,石墨电极上的电极反应式为___________________________________________________________,
电解反应的离子方程式为__________________________________________;
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com