
【题目】在标准状况下,将224L HCl气体溶于635mL水中,所得盐酸的密度为1.18gcm-3.试计算:
(1)所得盐酸的物质的量浓度是_________;
(2)取出这种盐酸10mL,稀释至118mL,所得稀盐酸的物质的量浓度是_________。若用量筒取10mL盐酸时仰视,其他操作均正确,则稀盐酸浓度_________(填“偏大”、 “不变”或“偏小”)。
(3)在40.0mL 0.065molL-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_________ mL?
【答案】(1)11.8mol/L;(2)1molL-1;偏大;(3)2.6
【解析】
试题分析:(1)n(HCl)=![]() =10mol,m(HCl)=10mol×36.5gmol-1=365g,
=10mol,m(HCl)=10mol×36.5gmol-1=365g,
635mL水的质量为635mL×1g/mL=635g,
盐酸的质量分数w=![]() ×100%=36.5%,
×100%=36.5%,
c(HCl)=![]() =
=![]() mol/L=11.8mol/L,
mol/L=11.8mol/L,
答:所得盐酸的物质的量浓度为11.8mol/L;
(2)根据c(浓)V(浓)=c(稀)V(稀)
可知:c(稀)=11.8molL-1×0.1L÷1.18L=1molL-1,若用量筒取10mL盐酸时仰视,导致浓度大的盐酸的体积偏大,则配制的稀盐酸浓度偏大,故答案为:1molL-1;偏大;
(3)n(Na2CO3)=0.040L×0.065molL-1=0.0026 mol,使反应不产生CO2气体,发生反应:Na2CO3+HCl═NaHCO3+NaCl,根据方程式可知消耗HCl为0.0026mol,设加入稀盐酸的体积最多不超过x mL,则n(HCl)=1molL-1×0.001x L=0.001x mol,根据反应Na2CO3+HCl═NaHCO3+NaCl,可得0.0026=0.001x,解得x=2.6,故答案为:2.6。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是由四种短周期元素中的两种或三种组成的5种化合物,其中乙、丙、戊均由两种元素组成,丙是导致温室效应的主要气体,戊是天然气的主要成分,乙和丁都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;甲由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

请回答下列问题:
(1)物质甲的化学式是 ,写出乙的一种用途是 。
(2)甲与足量H2O溶液反应的化学方程式 。
(3)将过量的丙通入某种物质的水溶液中可以生成丁,该反应的离子方程式为 。
(4)乙溶于某强碱溶液的离子方程式为 。
(5)在200 mL 1.5 mol·L-1NaOH溶液中通入标准状况下4.48 L 丙气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)丁是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol 丁投入1 L某浓度的盐酸中,为使丁完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组以甲酸为原料在实验室完成了一氧化碳和甲酸铜两种物质的制备实验。
实验一、用甲酸制备一氧化碳
CO的制备原理:HCOOH![]() CO↑+H2O,制备装置如下图(其中夹持仪器、加热仪器没有画出)
CO↑+H2O,制备装置如下图(其中夹持仪器、加热仪器没有画出)
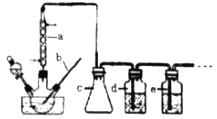
(1)b仪器的名称为___________,c的作用是___________。
(2)制备CO时,浓硫酸与甲酸的混合方式是___________。
实验二、用甲酸制备甲酸铜[Cu(HCOO)24H2O]
步骤一:碱式碳酸铜的制备
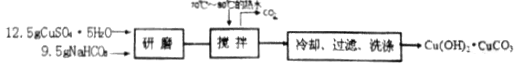
步骤二:甲酸铜的制备
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解,趁热过滤,滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)24H2O产品,称量,计算产率。回答下列问题:
左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)24H2O产品,称量,计算产率。回答下列问题:
(3)在制备碱式碳酸铜的过程中,如果温度过高,对产物有何影响?___________。
(4)步骤二中碱式碳酸铜滴入甲酸生成四水合甲酸铜的化学方程式为___________。
(5)本实验涉及三种固液分离的方法.
①倾析法使用到的仪器有___________;
②采用减压过滤的装置对步骤二中溶解后的溶液进行趁热过滤;
③步骤二的实验中,需用到下列装置___________

(6)最终称量所得的产品为7.91g,则产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)![]() 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(I2)= 。
(2)2min未c(HI)= mol/L。
(3)起始时,c(H2)= mol/L,反应进行到2min时,容器中I2所占的体积分数是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率,她成为首获科学类诺贝尔奖的中国人。青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯。下列有关说法正确的是( )
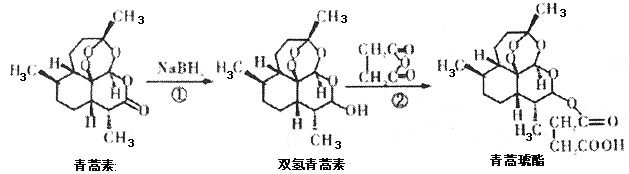
A.青蒿素分子式为C15H24O5
B.反应②原子利用率为100%
C.该过程中青蒿素生成双氢青蒿素属于氧化反应
D.1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5mol/L,可认为该离子不存在)。下列说法不正确的是

A.某温度下,CO2饱和溶液的浓度是0.05 molL-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1mol/LNa2CO3中c(HCO3﹣)比0.1mol/LH2CO3中c(HCO3﹣)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的化学方程式为________________________________________。
(2)装置A的烧瓶中可装的试剂为___________________。
(3)E装置的作用______________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________________________________________________。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为_______________mol-1(用含a、b的代数式表示)。
从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,实验室常用烧碱溶液吸收Cl2。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为8︰1时,混合液中NaClO和NaClO3的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在298K,100kPa时.CH4的燃烧热是890.0kJ/mol,写出该反应的热化学方程式__________。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,共放出QkJ热量(假定热量未损失),则CH4和CO的物质的量的比为__________。
(2)利用甲烷的燃烧反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液.多孔石墨作电极,在电极上分别通入甲烷和氧气,通入甲烷气体的电极上发生的电极反应是___________,当电路中转移12mol电子时,实际提供的电能是890.0kJ,则该电池的能量转化效率是__________。
(3)将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:

①当开关K1闭合,则铁发生电化学腐蚀中的__________腐蚀。
②当开关K2闭合,则总反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是
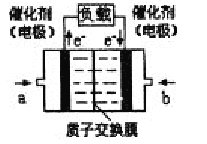
A.右电极为电池正极,b处通入的物质是空气
B.左电极为电池负极,a处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e—=CO2+6H+
D.正极反应式为:O2+4H++4e—=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com