
����Ŀ��������������(FeSO4�� 7H2O)�׳��̷������������»�ֽ⡣ij��ѧ�о�С����������װ��̽��FeSO4�ֽ��IJ��
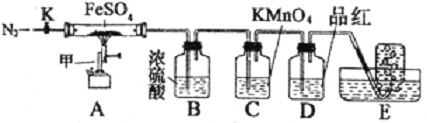
ʵ�鲽����
��ͼ��װ������(��ʡ�Լг�����)�����װ�õ������ԣ�ȷ��ȡmgFeSO4��������Ӳ�ʲ������У���E�еĵ��ܳ���ˮ�ۣ�����K��ͨ��һ��ʱ���N2���رջ���K������A�еIJ�����һ��ʱ���E�е�������ˮ������ƿ���ռ����������ô����ǵ�ľ������E�����ռ������壬�����ǵ�ľ���ܹ���ȼ����A�й��岻�ٷ����ֹͣ���ȣ���K������ͨ�뵪������������ȴ���õ�����ɫ��ĩ����ش�����������
��1��������������__________��
��2��B��Ũ���������__________��
��3��ʵ������з���C����Һ��ɫ��dz��D�������Ա仯��д��C�з�����Ӧ�����ӷ���ʽ__________��
��4�� FeSO4��ȫ�ֽ����Ҫͨ��һ��ʱ��N2��ԭ����__________��
��5����C��ԭ�ȼ�����20mL 1.00mol/L��KMnO4��Һ��Ϊ��ȷ��FeSO4�ֽ�Ļ�ѧ����ʽ��ijͬѧ����������ʵ����
��������Bװ����ʵ��ǰ������ 0.80g��
������ʵ���C�е���Һȫ��ת����100mL����ƿ�У�����ˮϡ�����̶��ߣ�
����ȷ��ȡ20.00mL��Һ����ƿ�У���������ϡ�����ữ����0.20mo1/L��H2C2O4��Һ�ζ����յ���
�����ظ�ʵ��3��.��¼����������
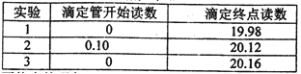
���ζ����յ������__________��
��FeSO4�ֽ�Ļ�ѧ����ʽΪ__________��
��6�������һ��ʵ��������A�е�FeSO4�Ƿ���ȫ�ֽ�__________��
���𰸡���1���ƾ���ƣ�
��2�����շֽ������SO3��
��3��5SO2+2MnO4��+2H2O=5SO42��+2Mn2++4H+
��4����װ���ڲ�����������������װ������ȫ���գ�ͬʱ��ֹ����������
��5������Һ��dz��ɫ(��dz��ɫ)�����ɫ���Ұ���Ӳ��ָ���dz��ɫ��
��8FeSO4![]() 4Fe2O3+ 6SO2��+ 2SO3��+ O2��
4Fe2O3+ 6SO2��+ 2SO3��+ O2��
��6������Ӧ��Ĺ���ת����С�ձ��У���������ˮ�����裬���ˣ�ȡ������Һ���Թ��У����뼸��K3[Fe(CN)6]��Һ��������������ɫ������˵��FeSO4û����ȫ�ֽ⣬��֮��ֽ���ȫ��(���������𰸾���)
��������
�����������1��������Ϊ�ƾ���ƣ��ʴ�Ϊ���ƾ���ƣ�
��2�����������ֽ����ɶ�������������������������B��Ũ�����������շֽ�������SO3���ʴ�Ϊ�����շֽ������SO3��
��3������������л�ԭ�ԣ��ܹ����������������C�з�����Ӧ�����ӷ���ʽΪ5SO2+2MnO4��+2H2O=5SO42��+2Mn2++4H+���ʴ�Ϊ��5SO2+2MnO4��+2H2O=5SO42��+2Mn2++4H+��
��4�� FeSO4��ȫ�ֽ������ͨ��һ��ʱ��N2��������װ���ڲ�����������������װ������ȫ���գ�ͬʱ��ֹ�����������ʴ�Ϊ����װ���ڲ�����������������װ������ȫ���գ�ͬʱ��ֹ����������
��5�������������Һ����ɫ���ζ��յ�������Ϊ��Һ��dz��ɫ(��dz��ɫ)�����ɫ���Ұ���Ӳ��ָ���dz��ɫ���ʴ�Ϊ����Һ��dz��ɫ(��dz��ɫ)�����ɫ���Ұ���Ӳ��ָ���dz��ɫ��
��E���ռ������壬�ܹ�ʹ�����ǵ�ľ����ȼ��˵����������������FeSO4�ֽ�Ļ�ѧ����ʽΪ8FeSO4![]() 4Fe2O3+ 6SO2��+ 2SO3��+ O2�����ʴ�Ϊ��8FeSO4
4Fe2O3+ 6SO2��+ 2SO3��+ O2�����ʴ�Ϊ��8FeSO4![]() 4Fe2O3+ 6SO2��+ 2SO3��+ O2����
4Fe2O3+ 6SO2��+ 2SO3��+ O2����
��6������A�е�FeSO4�Ƿ���ȫ�ֽ���ֻҪ�����Ƿ�����������Ӽ��ɣ��ʴ�Ϊ������Ӧ��Ĺ���ת����С�ձ��У���������ˮ�����裬���ˣ�ȡ������Һ���Թ��У����뼸��K3[Fe(CN)6]��Һ��������������ɫ������˵��FeSO4û����ȫ�ֽ⣬��֮��ֽ���ȫ��


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½�0.04��������������ˮ���Ƴ�100 mL��Һ���ʵ���Ũ��Ϊ____mol/L�� pHΪ______��Ҫʹ����pH��Ϊ11��(������Һ����������ϡ��ǰ��Һ�����֮��)����������ˮ��Ӧ��________mL��������pHΪ10��NaOH��Һ��Ӧ��______mL��������0.01 mol��L��1�����ᣬӦ��________mL(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������г���һ������NO2��������Ӧ2NO2��g��![]() N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
��������ͼ��ʾ������˵����ȷ���ǣ� ��

A��a��c����ķ�Ӧ���ʣ�a��c
B��a��b�����ת���ʣ�a��b
C��a��c�����������ɫ��a�cdz
D����a�㵽b�㣬�����ü��ȵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M���ӵ����ģ����ͼ��ʾ����AΪԭ�Ϻϳ�B��M��·�����£�

��֪��A����Է�������Ϊ26��
��1��A������Ϊ____________ ��M�ķ���ʽΪ____________��
��2����״��B�ĺ˴Ź���������ֻ��һ�ַ壬����ʹ������Ȼ�̼��Һ��ɫ����B�Ľṹ��ʽΪ____________��
��3����1molE��ȫת��ΪFʱ����Ҫ____________ molNaOH��
��4��G�еĺ��������ŵ�������____________��д����G��Ӧ���ɸ߷��ӵĻ�ѧ��Ӧ����ʽ��____________��
��5��M��ͬ���칹���ж��֣����������������ͬ���칹�干��____________����
���ܷ���������Ӧ �����б����ұ�����һ��ȡ����������
����FeCl3��Һ������ɫ
��1mol���л����������Ʒ�Ӧ����1mol����(һ��̼ԭ����ͬʱ��������-OH���ȶ�)
������һЩ���������ɵ���Ԫȩ��д������һ�ֵĽṹ��ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ����������ʾ��ͼ������

��1����������(ClO2)��һ�ָ�Ч����ȫ��ˮ����������C12�á������������Ʊ�C1O2������
����һ��2NaClO3+4HCl=2C1O2��+Cl2��+2NaCl+2H2O
��������2NaC lO3 +H2O2+H2SO4=2C lO2�� +Na2SO4ʮO2��+2H2O
�÷������Ʊ���C1O2���ʺ���������ˮ����������Ҫԭ����__________��
C1O2��C12������ʱ����������ԭΪCl-�� C1O2�����������ǵ�����Cl2��_________��
��2�����н϶�ĸơ�þ���ӵ�ˮ����ΪӲˮ����ʱӲˮ���������������_________��
����Ӳˮһ�����ʹ�����ӽ�����֬�������Ȱ�ˮͨ��װ��_________ (����������������)���ӽ�����֬�Ľ���������ͨ����һ�ֹ��ܵ����ӽ�����֬��ʹ�ú�������ӽ�����֬��������_________��������
��3��ˮ�����г����Ļ����������������ۺϷջ����������������������ȡ�����������Ϊ�������ڳ�ȥ��������ʱ����Ҫ��ˮ��pH����9���ң�ԭ����_________��
��4������������һ���������ӽ���Ĥ���к�ˮ�����ķ���.��ͼ�ǵ���������ʾ��ͼ����ˮ��_________(����A������B������C��)����������Ϊ_________���ӽ���Ĥ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ľṹ��ͼ��ʾ�����ڿ������������ȷ����()

A����÷����廯�������ʽ��ͬ�����������༰��Ŀ����ͬ�ұ����ϵ�һ�ȴ���ֻ�����ֵ��л���Ľṹ��4��(�����ǿռ��칹)
B��������ֻ�ܼӾ۳ɸ߷��ӻ�����
C��������������5mol���������ӳɷ�Ӧ
D��1mol��������������Na2CO3��Һ��Ӧ��������3 mol CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ������������������ֶ�����Ԫ���е����ֻ�������ɵ�5�ֻ���������ҡ��������������Ԫ����ɣ����ǵ�������ЧӦ����Ҫ���壬������Ȼ������Ҫ�ɷ֣��ҺͶ����������ᷴӦ��������ǿ����Һ��Ӧ������5�ֻ������漰������Ԫ�ص�ԭ������֮�͵���28������һ�ֽ���Ԫ�غ����ַǽ���Ԫ����ɣ���ԭ�Ӹ�����Ϊ1�U3�U9������ԭ����������������н���Ԫ�ص�ԭ������������֮��ķ�Ӧ��ϵ����ͼ��

��ش���������:
��1�����ʼĻ�ѧʽ�� ��д���ҵ�һ����;�� ��
��2����������H2O��Һ��Ӧ�Ļ�ѧ����ʽ ��
��3���������ı�ͨ��ij�����ʵ�ˮ��Һ�п������ɶ����÷�Ӧ�����ӷ���ʽΪ ��
��4��������ijǿ����Һ�����ӷ���ʽΪ ��
��5����200 mL 1.5 mol��L-1NaOH��Һ��ͨ���״����4.48 L �����壬��ȫ��Ӧ��������Һ�У���������Ũ���ɴ�С��˳���� ��
��6������һ���������ʣ����ܶȻ�����Ϊ1.25��10-33����0.01 mol ��Ͷ��1 LijŨ�ȵ������У�Ϊʹ����ȫ�ܽ�õ���������Һ���������Ũ������ӦΪ ������仯���Բ��ƣ����������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪͭ˿��Ũ���ᷴӦ����֤��������ʵ�ʵ��װ�á�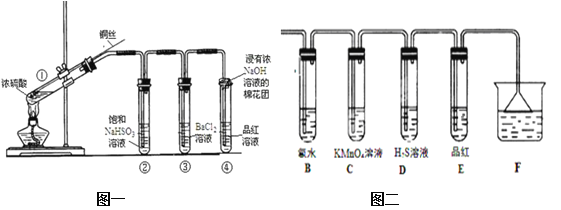
��1�����з�Ӧ�Ļ�ѧ����ʽ�� ������ͭ������ (���������ԭ��)��Ӧ���ж�����Ϊ _______________ ��
��2��Ũ�����ڴ˷�Ӧ��������_________�Ժ�____________�ԡ�
��3�����б���NaHSO3��Һ�������dz�ȥ���лӷ��������ᡣ����һ��ʱ���������Һ��Ȼ���壬������Һ��ɫ����Ҫ������ֹͭ������ķ�Ӧ����ǡ���ķ����� _____________��
a������ͭ˿��ʹ���������� b����ȥ�ƾ��� c����ȥ������������
��4����Ӧֹͣ��װ����ȴ����������Һ����NaOH��Һ���۲쵽��������__________��
��5���������ŵ������� ____ ��
��6������Ũ������ͭ��Ӧ�����������ͨ��ͼ����װ��������Ӧ��װ��B�з����������� ����Ӧ�Ļ�ѧ����ʽΪ ______________________��װ��C�е������� ��������SO2�� �ԣ�װ��D�������� ��������SO2�� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����H2��I2(g)�����ܱ������н��з�Ӧ��H2��I2��g��![]() 2HI����Ӧ���е�2minʱ��÷�Ӧ���ʦԣ�HI��=0.1mol/��L��min����I2(g)�����ʵ���Ũ��Ϊ0.4mol/L��
2HI����Ӧ���е�2minʱ��÷�Ӧ���ʦԣ�HI��=0.1mol/��L��min����I2(g)�����ʵ���Ũ��Ϊ0.4mol/L��
��1����Ӧ���ʦԣ�I2���� ��
��2��2minδc(HI)�� mol/L��
��3����ʼʱ��c(H2)�� mol/L����Ӧ���е�2minʱ��������I2��ռ�����������_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com