
【题目】生产环氧乙烷(![]() )的反应为:2CH2=CH2(g)+O2(g)
)的反应为:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH=-106kJ/mol,其反应机理如下:
(g) ΔH=-106kJ/mol,其反应机理如下:
①Ag+O2→AgO2 慢
②CH2=CH2+AgO2→![]() + AgO 快
+ AgO 快
③CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是
A. 反应的活化能等于106 kJ/mol
B. 该反应的原子利用率为100%
C. AgO2也是该反应的催化剂
D. 增大乙烯的浓度只能显著提高环氧乙烷的生成速率
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定 25.00 mL 0.100 0 mol L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是( )

A. 点①所示溶液中:c(H+)+c(H2C2O4)+ c(HC2O4-)=c(OH-)
B. 点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C. 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 滴定过程中可能出现:c(Na+) > c(C2O42-) =c(HC2O4-)>C(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关实验的叙述中,正确的是( )
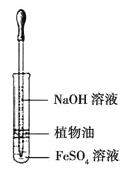
A. HClO、活性炭均能使某些有色物质褪色,说明二者均有氧化性
B. 加热分别盛有NaHCO3和碘的两支试管,试管底部固体均减少,说明二者均发生升华
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来
D. 用上图装置观察 Fe(OH)2 的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走近课堂,下列做法符合“绿色化学”理念的是

①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠反应的实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与HCl反应生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A. ②③④ B. ①②③
C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol·L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列叙述错误的是

A. C点溶液中含有NaHA和Na2A
B. NaHA溶液中水的电离程度比Na2A溶液中小
C. B点,c (Na+)=2[c (H2A)+c (HA)+c (A2-)]
D. D点,c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
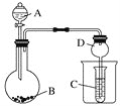
A. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
D. 实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
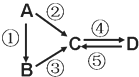
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_________;④反应离子方程式__________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_______________________。④反应的离子方程式______________。D中加入氢氧化钠的现象__________。
(3)若A是太阳能电池用的光伏材料,B常用用于制作高档光学器材,C、D为钠盐,C的水溶液俗称泡花碱,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A. c(H+)= c(CH3COO-)+ c(OH-)
B. 加入少量CH3COONa固体后,c(CH3COO-)降低
C. 该溶液中由水电离出的c(H+)是1.0×10-11mol/L
D. 与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O![]() ):c(HC2O)=______。
):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
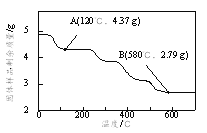
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com