
����Ŀ������Һ�У���ӦA+2B![]() C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊ
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊ![]() ��
��![]() ��
��![]() ����Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��
����Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��
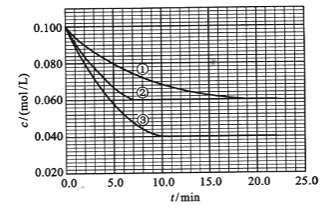
��ش��������⣺
��1����ٱȽϣ��ں͢۷ֱ���ı�һ�ַ�Ӧ���������ı���������жϵ������ǣ���_______________����_______________��
��2��ʵ���ƽ��ʱB��ת����Ϊ_________��ʵ���ƽ��ʱC��Ũ��Ϊ____________��
��3���÷�Ӧ��Q_____0���ж���������________________��
��4���÷�Ӧ���е�4.0minʱ��ƽ����Ӧ�ٶ��ʣ�ʵ��ڣ�![]() =____________________��
=____________________��
���𰸡���1��ʹ�ô�����������2��40%��0.06��3������ �����£�A��Ũ�ȼ��٣�ƽ��������Ӧ�����ƶ���4��0.014
��������
�����������1����ٱȽϣ��ڷ�Ӧ���ʼӿ죬��ƽ��û�ƶ����ı��������ʹ�ô�������ٱȽϣ��۷�Ӧ���ʼӿ죬ƽ��ʱA��Ũ�ȼ�С��ƽ�������ƶ������ı�������������¶ȣ�
��2��

ʵ���ƽ��ʱB��ת����Ϊ![]() ��
��

ʵ���ƽ��ʱ![]() ��
��
��3�����£�A��Ũ�ȼ��٣�ƽ��������Ӧ�����ƶ����÷�Ӧ�� Q>0��
��4����ͼ�϶��������е�4.0minʱ��ʵ��ڵ�A��Ũ��Ϊ��0.072mol/L,���C(A)=0.10-0.072=0.028mol/L��![]() ������
������![]() =2
=2![]() =0.014mol(L��min)-1����
=0.014mol(L��min)-1����


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ۡ������ʡ�������ˮ��Һ�����οɷֱ�ʹ�õ��Լ��Ͷ�Ӧ��������ȷ����( )
A����ˮ������ɫ ������Cu(OH)2��ש��ɫ������Ũ���ᣬ���ɫ
B��Ũ���ᣬ���ɫ ������Cu(OH) 2��ש��ɫ��������ˮ������ɫ
C������Cu(OH)2��ש��ɫ��������ˮ������ɫ��Ũ���ᣬ���ɫ
D����ˮ������ɫ �� Ũ���ᣬ���ɫ ������Cu(OH)2��ש��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA(g)��nB(g) ![]() pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
��1���÷�Ӧ���淴ӦΪ________�ȷ�Ӧ����m��n______p (�����������������) ��
��2����ѹʱ��A����������__________��(���������С�����䡱����ͬ)
��3�����ݻ��������B����B��ת����__________��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮�Ƚ�__________��
��5�������������ƽ��ʱ��������������ʵ���__________��
��6����B����ɫ���ʣ�A��C����ɫ�������C(�������)ʱ�������ɫ__________����ά��������ѹǿ���䣬��������ʱ���������ɫ ��(����������dz�����䡱)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. �ɷǽ���Ԫ����ɵĻ����ﲻ���������ӻ�����
B. ����ԭ����ǽ���ԭ��֮��Ҳ�����γɹ��ۼ�
C. ���ӻ������п��ܺ��й��ۼ�
D. ���ۻ������в����ܺ������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ��������������,��ȷ����
A. ���ӻ����ﲻ���ܺ����ۼ� B. ���ۻ�������ܺ����Ӽ�
C. ���ӻ�������ֻ�����Ӽ� D. ���ۻ������в������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ绯ѧԭ������NO2��O2������KNO3�Ƴ�ȼ�ϵ����ģ�ҵ��ⷨ��������Cr2O72-��ˮ������ͼ��ʾ������������Һ������Ӧ��Cr2O72-��6Fe2+��14H+��2Cr3+��6Fe3+��7H2O
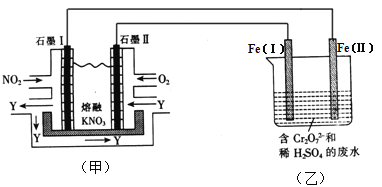
��1���׳ع���ʱ��NO2ת�����ɫ������Y��Y��N2O5����ѭ��ʹ�á���ʯī���ǵ�ص� ����ʯī�������ĵ缫��ӦʽΪ ��
��2������ʱ���׳��ڵ�NO3-������ ���ƶ����ʯī��ʯī��������ͬ�����£����ĵ�O2��NO2�������Ϊ ��
��3���ҳ���Fe(��)���Ϸ����ĵ缫��ӦΪ ��
��4������Һ�м�����0.01 mol Cr2O72-�����·������ת���� mol���ӡ�
��5������ȫ��ԭΪCr3+���ҳع�ҵ��ˮ�еμ�NaOH��Һ���ɽ�����Cr(OH)3��������ʽ��ȥ����֪Cr(OH)3���������ܽ�ƽ�⣺Cr(OH)3(s) ![]() Cr3+(aq)��3OH-(aq)��������Cr(OH)3���ܶȻ�Ksp=c(Cr3+)��c3(OH-)=1.0��10-32��Ҫʹc(Cr3+)����10��5mol��L-1����Һ��pHӦ���� ��
Cr3+(aq)��3OH-(aq)��������Cr(OH)3���ܶȻ�Ksp=c(Cr3+)��c3(OH-)=1.0��10-32��Ҫʹc(Cr3+)����10��5mol��L-1����Һ��pHӦ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
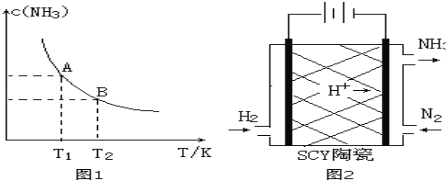
����Ŀ����1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ1��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
�����¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1 K2�����������������=�������ʱ���H 0���������������
���÷�Ӧ��T1�¶���5.00min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ ��
��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1= ��
��2���������¡��˹��̵������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g�����˷�Ӧ����S 0�������������������֪��N2��g��+3H2��g��=2NH3��g����H=a kJ/mol 2H2��g��+O2��g��=2H2O��l����H=b kJ/mol 2N2��g��+6H2O��l��=4NH3��g��+3O2��g������H= ���ú�a��b��ʽ�ӱ�ʾ����
��3����ѧ�Ҳ������Ӹߵ����Ե�SCY�մɣ��ɴ���H+��ʵ���˵��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��ԭ��ʾ��ͼ��ͼ2��ʾ���������ĵ缫��Ӧʽ�� ��
��4����֪ijЩ���������ˮ�еĵ���ƽ�ⳣ����25�������±���
������� | H2CO3 | NH3.H2O |
����ƽ�ⳣ�� | Ka1=4.30��10-7 Ka2=5.61��10-11 | Kb=1.77��10-5 |
���г�����0��1 mol��L-1�ģ�NH4��2CO3��Һ��
������Һ�� �ԣ���ᡱ�����С����������ԭ���� ��
���ã�NH4��2CO3��Һ�и���Ũ��֮��Ĺ�ϵʽ����ȷ���� ��
A��c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B��c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C��c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D��c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E��c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���л���A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ������AΪ��Ҫԭ�Ϻϳ�������������ϳ�·������ͼ��ʾ��

��1��A�����й����ŵ������� ��D�й����ŵ�������________��Ӧ�ٵķ�Ӧ������ ��Ӧ��
��2����Ӧ���Ļ�ѧ����ʽ�� ��
��Ӧ���Ļ�ѧ����ʽ�� ��
��3��E�dz����ĸ߷��Ӳ��ϣ��ϳ�E�Ļ�ѧ����ʽ�� ��
��4��ijͬѧ����ͼ��ʾ��ʵ��װ����ȡ��������������ʵ��������Թܼ����ϲ�Ϊ���ġ�������ˮ����״Һ�塣

�� ʵ�鿪ʼʱ���Թܼ��еĵ��ܲ�����Һ���µ�ԭ���� ��
������ʵ���б���̼������Һ��������(����ĸ) ��
A���к�������Ҵ�
B���к����Ტ���ղ����Ҵ�
C�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�и�С�������ڷֲ�����
D�������������ɣ���������
����ʵ��������B��D�Ʊ�����������ʵ���У�����1mol B��1mol D��ַ�Ӧ��__________����/���ܣ�����1mol ����������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ������ͼ��ʾʵ��װ�ý���ʵ�飨ͼ��a��b��c��ʾֹˮ�У���
![]()
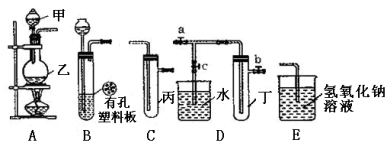
��1���ס����������������� ��
��2��A��C��E�������װ�ÿ�������ȡCl2��д��A�з�����Ӧ�Ļ�ѧ����ʽ ����Cl2ͨ�뺬�з�̪��NaOH��Һ�е������� ���÷�Ӧ�����ӷ���ʽΪ ��
��3��B��D��Eװ����������B��ʢװŨ�����ͭƬ��ͭƬ�����п����ϰ��ϣ������Ƶ�NO2�������й�ʵ�顣
��д���÷�Ӧ�����ӷ���ʽ ��
������Dװ����֤NO2��ˮ�ķ�Ӧ�����������Ϊ���ȹر�ֹˮ�� ���ٴ�ֹˮ�� ��ʹ�ձ��е�ˮ�����Թܶ��С�
���Թܶ��е�NO2��ˮ��ַ�Ӧ�������Թ��ڻ���ͨ��һ������O2��ֱ���Թ�ȫ������ˮ����������Һ�����ʵ����ʵ���Ũ���� mol��L1������2λ��Ч��ֵ�����尴��״�����㣩��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com