
【题目】将16.8 g铁投入200 mL某浓度的稀硫酸中,铁和稀硫酸恰好完全反应。求:
(1)16.8 g铁的物质的量为__________
(2)所用稀硫酸中H2SO4的物质的量浓度为_________
(3)反应中生成的H2在标准状况下的体积为________
(4)向反应后的溶液中加水至500 mL,求此时硫酸亚铁的物质的量浓度为_________
【答案】0.3mol 1.5mol/L 6.72L 0.6mol/L
【解析】
(1)根据![]() 计算;
计算;
(2)根据铁和稀硫酸的反应方程式计算硫酸的物质的量,根据c=![]() 计算;
计算;
(3)根据反应方程式算出生成氢气的物质的量,再求其标况下的体积;
(4)稀释溶液溶液中溶质的物质的量不变;
(1)Fe的摩尔质量为56g/mol,所以16.8 g铁的物质的量为![]() ,故答案为:0.3mol;
,故答案为:0.3mol;
(2)铁与稀硫酸反应方程式为:Fe+H2SO4=FeSO4+H2↑,根据方程式可知0.3mol Fe可以与0.3molH2SO4恰好完全反应,所以200mL溶液中硫酸的物质的量为0.3mol,物质的量浓度为![]() ,故答案为1.5mol/L;
,故答案为1.5mol/L;
(3)根据方程式Fe+H2SO4=FeSO4+H2↑可知生成的氢气的物质的量为0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,故答案为6.72L;
(4)反应后的溶液中FeSO4物质的量为0.3mol,稀释后溶质的物质的量不变,所以硫酸亚铁的物质的量浓度为![]() ,故答案为:0.6mol/L。
,故答案为:0.6mol/L。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.红褐色固体![]() 全部溶于氢碘酸:
全部溶于氢碘酸:![]()
B.水杨酸溶于![]() 溶液中:
溶液中:![]()
C.将等浓度的![]() 溶液与
溶液与![]() 液按体积比2:3混合:
液按体积比2:3混合:![]()
D.洁厕灵(含![]() )与84消毒液混合后产生氯气:
)与84消毒液混合后产生氯气:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。
(2)0~2 s内该反应的平均速率v(NO)=__________, v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图所示。该晶体中铁、氮的微粒个数之比为______。
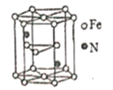
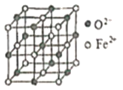
(6)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应:
①若所含溶质的物质的量相等,则生成沉淀的物质的量之比是 _________ ;
②若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量之比是 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氧气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知儿种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH=___kJ·mol-1。
N2(g)+2H2O(g) ΔH=___kJ·mol-1。
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2:H2O2(g)+H2(g)![]() 2H2O(g)。
2H2O(g)。
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,活化能较大的是反应___(填“l”或“2”)。c(NO)对总反应速率的影响程度___c(H2)(填“大于”“小于”或“等于”)。
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)。
7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是___(填字母)。
A.混合气体密度保持不变 B.NO2和N2的消耗速率之比为6:7
C.混合气体中c(N2)=c(NO2) D.混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
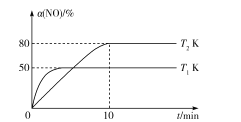
(4)下列说法正确的是___(填字母)。
A.图像中,T1>T2
B.上述反应在高温下能自发进行
C.10min时,T2K下正、逆反应速率相等
D.增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=___mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=___L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则平衡___(填“向右移动”“向左移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
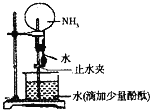
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性
C.氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化
D.形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
(1)比较a___b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1____T2(填“>” “=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度___(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系_______(用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是_____。
A.4molA和2molB B.4molA、2molB和2molC C.4molA和4molB D.6molA和4molB
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
A.及时分离出C气体 B.适当升高温度 C.增大B的浓度 D.选择高效催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d_____b(填“>”“=”或“<”),理由是_________。
(6)在一定温度下,向一个容积可变的容器中,加入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com