
现有部分短周期主族元素的性质或原子结构如下表所示:
| 元素编号 | 元素性质或原子结构 |
| X | 周期序数=主族序数=原子序数 |
| Y | 原子最外层电子数为a,次外层电子数为b |
| Z | 原子L层电子数为a+b,M层电子数为a-b |
| M | 单质在自然界中的硬度最大 |
| N | 位于第3周期,最外层电子数是电子层数的2倍 |
(1)写出X、Y、Z、N四种元素的名称:X________,Y________,Z________,N________。
(2)由X、Y、Z、M、N五种元素两两组成的分子中,许多分子含有的电子数相等 ,写出符合下列要求的分子式:
,写出符合下列要求的分子式:
①含10e-且呈正四面体结构的分子________;
②含14e-的双原子分子________;
③含16e-且能使溴水褪色的分子________;
④含18e-且常温下呈液态的分子_______ _。
_。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
I:已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol•L-1)变化
| 时间/ min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 ,T℃时该化学反应的平衡常数是 。
在该温度下,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和2.0mol H2,则反应向 进行。(填“正反应方向”或“逆反应方向”)
(2)已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol•L-1,则CO在此条件下的转化率为 ,如果保持体积不变向该密闭容器中再充入1 mol氩气,平衡时CO的转化率 (填“变大”“不变”“变小”)
(3)397℃时该反应的平衡常数为12,请判断该反应的△H 0(填“>”、“=”、“<”).
II:工业上可用CO和H2在一定条件下合成甲醇,反应为:
CO(g)+2H2(g)⇌ CH3OH(g)ΔH=Q kJ•mol-1
现在容积均为2L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 |
(1)该反应的Q 0(选填“<”、“>”或“=”,下同),K1 K2。
(2)300℃时,该反应的平衡常数为 。
(3)将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有:____________
(至少答2种) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,且气体体积为标况体积):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___________,
原因是 。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体
积的下列溶液,你认为可行的是__________。
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
据新闻网报道:科学家首次合成第117号元素,被美国《时代》周刊评选为当年十大科学发现。假如第117号元素符号暂时定为Up,下列关于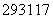 Up和
Up和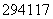 Up的说法中正确的是( )
Up的说法中正确的是( )
A.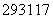 Up和
Up和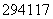 Up是两种元素
Up是两种元素
B.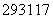 Up和
Up和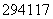 Up互为同位素
Up互为同位素
C.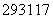 Up和
Up和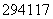 Up质子数不同、中子数相同
Up质子数不同、中子数相同
D.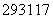 Up和
Up和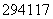 Up质量数相同、电子数不同
Up质量数相同、电子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
假设R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则W g Rm-离子所含中子的物质的量为( )
 A.(A-x+m) mol
A.(A-x+m) mol
B.(A-x-m) mol
C.  (A-x+m) mol
(A-x+m) mol
D.  (A-x-m) mol
(A-x-m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
要检验溴乙烷中的卤素是不是溴元素,正确的实验方法是 ( )
①加入氯水振荡,观察水是否有红棕色的溴出现
②加入NaOH溶液共热,冷却后加入稀硝酸至酸性,再滴入AgNO3溶液,观察有无浅色沉淀生成
③滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成
④加入NaOH的醇溶液共热,冷却后加入稀硝酸至酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
A.①③ B.②④ C.①② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。其中Y所处的周期序数与族序数相等。下列说法正确的是( )
| X | |||
| Y | Z | W |
A.原子半径:Y<Z<W
B.气态氢化物的稳定性:X>Z
C.最高价氧化物对应水化物的酸性:Z>W
D.W的最高价氧化物与水反应形成的化合物是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com