
| A����10 NA������ת��ʱ������1300 kJ������ |
| B����NA��C2H2���Ӳμӷ�Ӧʱ���ų�1300 kJ������ |
| C����NA��������̼��������ʱ���ų�1300 kJ������ |
| D����NA��ˮ��������ʱ������1300 kJ������ |
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����6a+5d-4c-12b�� kJ��mol-1 |
| B����4c +12b -6a-5d�� kJ��mol-1 |
| C����4c +12b -4a-5d�� kJ��mol-1 |
| D����4a+5d-4c -12b�� kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��������̼������,�������з�����������ʵ�ֽ��ܼ��š��������õȡ�
��������̼������,�������з�����������ʵ�ֽ��ܼ��š��������õȡ�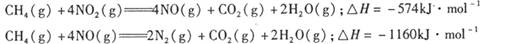
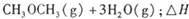 ����֪��һ��ѹǿ��,�÷�Ӧ���¶ȵ����߶�CO2��ת���ʽ��͡���÷�Ӧ��
����֪��һ��ѹǿ��,�÷�Ӧ���¶ȵ����߶�CO2��ת���ʽ��͡���÷�Ӧ��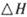 ________ 0(� >���� <�����������Լ��ѡ�����������������ҺΪԭ�ϣ�ʯīΪ�缫����ȼ�ϵ��,��õ���и����ĵ缫��Ӧʽ��________________________________,�ŵ��������Һ��PH________ (���������С�����䡱����
________ 0(� >���� <�����������Լ��ѡ�����������������ҺΪԭ�ϣ�ʯīΪ�缫����ȼ�ϵ��,��õ���и����ĵ缫��Ӧʽ��________________________________,�ŵ��������Һ��PH________ (���������С�����䡱�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
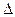 H1=" +1175.7" kJ��mol-1
H1=" +1175.7" kJ��mol-1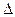 H2=" +771.1" kJ��mol-1
H2=" +771.1" kJ��mol-1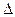 H3=" -482.2" kJ��mol-1
H3=" -482.2" kJ��mol-1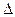 H��
H��| A��77.6 kJ | B��-77.6 kJ��mol-1 | C��+77.6kJ��mol-1 | D��-886.8kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
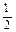 O2(g) =" CO" (g)
O2(g) =" CO" (g) 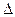 H1= ��110.5kJ/mol
H1= ��110.5kJ/mol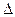 H2= ��393.5kJ/mol
H2= ��393.5kJ/mol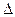 HΪ
HΪ| A��+ 283.5kJ/mol | B��+ 172.5kJ/mol |
| C����172.5kJ/mol | D����504kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a��c��0 | B��b��d��0 | C��2a="b��0" | D��2c=d��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����824.4kJ��mol�� 1 | B����627.6kJ��mol��1 |
| C����744.7kJ��mol��1 | D����169.4kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
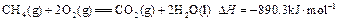 ������0.75mol CH4��CO�Ļ�����壬��ȫȼ�պ�����CO2(g)��18g H2O(l)�����ų�515.9kJ���������Ͽ�֪1mol CO��ȫȼ�շų�������Ϊ�� ��
������0.75mol CH4��CO�Ļ�����壬��ȫȼ�պ�����CO2(g)��18g H2O(l)�����ų�515.9kJ���������Ͽ�֪1mol CO��ȫȼ�շų�������Ϊ�� ��A��283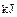 | B��374.4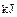 | C��512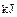 | D��566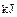 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com