
 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
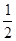 O2(g)=H2O(l) ��H3="-285.8KJ/mol "
O2(g)=H2O(l) ��H3="-285.8KJ/mol " | A��-488.3 KJ/mol | B��+488.3KJ/mol |
| C��-245.7KJ/mol | D��+245.7KJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH (g) ��H 1����Ӧ��
CH3OH (g) ��H 1����Ӧ��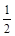 O2(g)��CO2(g) ��H 2����283 kJ��mol��
O2(g)��CO2(g) ��H 2����283 kJ��mol�� 1 (��Ӧ��)
1 (��Ӧ��)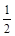 O2(g)��H2O(g) ��H3����242 kJ��mol��1 (��Ӧ��)
O2(g)��H2O(g) ��H3����242 kJ��mol��1 (��Ӧ��)| ��ѧ�� | C��C | C��H | H��H | C��O | C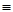 O O | H��O |
| ���ܣ�kJ��mol��1 | 348 | 413 | 436 | 358 | 1072 | 463 |
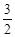 O2(g)��CO2(g)��2H2O(g) ��H4
O2(g)��CO2(g)��2H2O(g) ��H4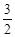 O2(g)��CO2(g)��2H2O(l)���乤��ԭ��ʾ��ͼ���£�
O2(g)��CO2(g)��2H2O(l)���乤��ԭ��ʾ��ͼ���£�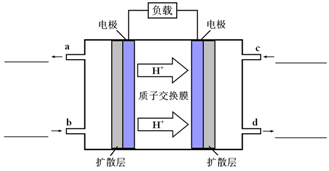
 ѧʽ��
ѧʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
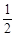 O2(g)
O2(g) | A���C 283��01 kJ �� mol �C 1 | B��+ 172��51 kJ �� mol �C 1 |
| C��+ 283��01 kJ �� mol �C 1 | D��+ 504��00 kJ �� mol �C 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2N2H4(g)��2NO2(g)===3N2(g)��4H2O(l) ��H����1135.7 kJ��mol��1 |
| B��2N2H4(g)��2NO2(g)===3N2(g)��4H2O(g) ��H����1000.3 kJ��mol��1 |
| C��N2H4(g)��NO2(g)===3/2N2(g)��2H2O(l) ��H����1135.7 kJ��mol��1 |
| D��2N2H4(g)��2NO2(g)===3N2(g)��4H2O(g) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |

| A������ | B������ | C����ѹ | D����ȥ���ַ�Ӧ�� E.���븺���� |
| ʵ�� ��� | �¶�/K | ����Ũ�� /mol��L-1 | ����Ũ��/mol��L-1 | ʵ��Ŀ�� |
| �� | 298 | 0.20 | | a.ʵ��ٺ͢ڣ�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 b.ʵ��ٺۣ͢�̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻 c.ʵ��ܢݣ�̽���¶ȶ�þ�����ᷴӦ��þ����ᷴӦ���ʵ�Ӱ�죬�ĸ�����һЩ�� |
| �� | 308 | 0.20 | | |
| �� | 298 | 0.40 | | |
| �� | | 0.20 | 0.20 | |
| �� | | | |
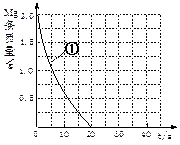
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����10 NA������ת��ʱ������1300 kJ������ |
| B����NA��C2H2���Ӳμӷ�Ӧʱ���ų�1300 kJ������ |
| C����NA��������̼��������ʱ���ų�1300 kJ������ |
| D����NA��ˮ��������ʱ������1300 kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
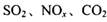 �ǶԻ���Ӱ��ϴ�Ķ������壬�����ǵĺ������ƺ��������Ż��������滷������Ч;����
�ǶԻ���Ӱ��ϴ�Ķ������壬�����ǵĺ������ƺ��������Ż��������滷������Ч;���� Ũ�ȵ���__________ (ѡ����ĸ)��
Ũ�ȵ���__________ (ѡ����ĸ)��


 �����£�
�����£�
 ,��ƽ�ⳣ��K=13.3��
,��ƽ�ⳣ��K=13.3�� ����
���� =_______________(������λ��Ч����)��
=_______________(������λ��Ч����)��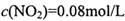 ��
�� ����ı��������____________________
����ı��������____________________�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
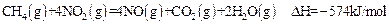
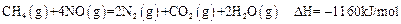
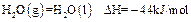
| A�������ʵ�����CH4�μӷ�Ӧ����Ӧ�٢�ת�Ƶĵ�������ͬ |
| B��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);�SH=-618KJ/mol |
| C��0.2 mol CH4��ԭNO2��N2��������H2O(g)�ų�������Ϊ173��4kJ |
| D������4��48 L(��״��)CH4��ԭNO2��N2������������ת�Ƶ���1.60mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com