
 CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)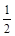 O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)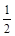 O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)| 化学键 | C-C | C-H | H-H | C-O | C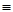 O O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
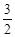 O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4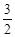 O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下: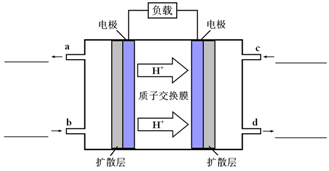
 学式)
学式) 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:不详 题型:单选题

| A.404 | B.260 | C.230 | D.200 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g)+
H2(g)+ I2(g)══HI(g) ΔΗ="+26" kJ·mol-1的叙述中,正确的是
I2(g)══HI(g) ΔΗ="+26" kJ·mol-1的叙述中,正确的是| A.1 mol氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量 |
| B.1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量 |
| C.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol的HI气体需吸收52 kJ的热量 |
D. mol H2(g)与 mol H2(g)与 mol I2(g)完全反应放出26 kJ的热量 mol I2(g)完全反应放出26 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
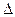 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1 H2=" +771.1" kJ·mol-1
H2=" +771.1" kJ·mol-1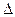 H3=" -482.2" kJ·mol-1
H3=" -482.2" kJ·mol-1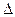 H是
H是| A.77.6 kJ | B.-77.6 kJ·mol-1 | C.+77.6kJ·mol-1 | D.-886.8kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
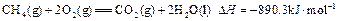 。现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9kJ热量,由上可知1mol CO完全燃烧放出的热量为( )
。现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9kJ热量,由上可知1mol CO完全燃烧放出的热量为( )A.283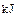 | B.374.4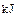 | C.512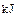 | D.566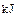 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸和NaOH溶液反应,生成 l mol水时放热57.3 kJ |
| B.含l molH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ |
| C.1L 0.l mol/L CH3COOH与1L 0.l mol/L NaOH溶液反应后放热为5.73 kJ |
| D.1L 0.l mol/L HNO3与 1L 0.l mol/L NaOH溶液反应后放热为 5.73 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com