
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
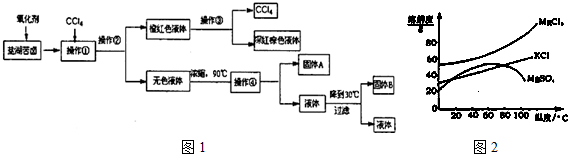
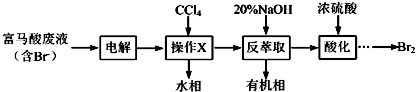
分析 该实验流程是:向富含K+、Mg2+、Br-、SO42-、Cl-的混合物中加入氧化剂,将溴离子氧化为溴单质,再加入四氯化碳萃取剂将混合物中的溴单质提取出来,对于剩余的混合物,加入氢氧化剂和氯化钡将镁离子和硫酸根离子沉淀下来,为保证沉淀干净,所加试剂过量,最后多余的氢氧根离子和碳酸根离子在加入盐酸将之反应掉.由溶解度图象知,将得到的溶液进行蒸发浓缩至90℃后进行结晶,再将固液不相溶的物质进行分离的操作叫过滤,此时所用的玻璃仪器有玻璃棒、烧杯、漏斗;在90℃时得到的固体A为MgSO4,而30℃时得到的固体B为KCl,所以应用冷水洗涤固体B,才可以得到较纯净的氯化钾.在减压条件下进行过滤,可使过滤的速度加快.
(1)实现溴和水溶液的分离可以加萃取剂来萃取分液,实现互溶液体的分离采用蒸馏的方法,根据过滤仪器来选择合适的仪器;
(2)由实验目的制取较纯净的氯化钾晶体可知,要除掉无色溶液中的Mg2+、SO42-,因此固体A为硫酸镁;
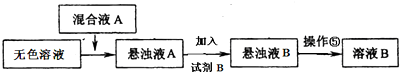
(3)①在提纯时,加入氢氧化钾、氯化钡可以分别将镁离子以及硫酸根离子除去;
②除去杂质离子时,为保证除净,加入的试剂是过量的,最后加盐酸可以除去多余的碳酸根和氢氧根;
③根据蒸发结晶实验的原则:当出现较多晶体,剩余较少水时,停止加热,用余热蒸干;
④为保证沉淀的彻底,要将混合物加热,使沉淀颗粒增大,根据Ksp=[Mg2+][OH-]2来计算回答.
解答 解:(1)实现溴单质和其他水溶液的分离可以加萃取剂四氯化碳萃取分液,所以操作①的名称是萃取,操作②名称是分液,实现互溶液体溴的四氯化碳溶液的分离采用蒸馏的方法,用到的玻璃仪器有:分液漏斗,
故答案为:分液漏斗;
(2)由实验目的制取较纯净的氯化钾晶体可知,要除掉无色溶液中的Mg2+、SO42-,因此固体A为硫酸镁,
故答案为:MgSO4 ;
(3)①在提纯时,加入氢氧化钾、氯化钡可以分别将镁离子以及硫酸根离子除去,除去杂质离子时,为保证除净,加入的试剂是过量的,所以混合液A的主要成分是BaCl2和KOH,故答案为:Ba(OH)2(或BaCl2和KOH);
②在提纯时,加入氢氧化钾、氯化钡可以分别将镁离子以及硫酸根离子除去,除去杂质离子时,为保证除净,加入的试剂是过量的,最后加盐酸可以除去多余的碳酸根和氢氧根,
故答案为:加盐酸调节至pH=5目的是除去未反应的OH-和CO32-;
③根据蒸发结晶实验的原则:在蒸发皿中,当出现较多晶体,剩余较少水时,停止加热,用余热蒸干,
故答案为:出现较多晶体,剩余较少水时;
④为保证沉淀的彻底,要将混合物加热,使沉淀颗粒增大,根据Ksp=[Mg2+][OH-]2,则溶解B中Mg2+物质的量浓度c=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1.6×1{0}^{-11}}{(1{0}^{-2})^{2}}$=1.6×10-7mol/L,
故答案为:1.6×10-7mol/L.
点评 本题是一道有关粗盐提纯知识的综合实验题目,要求学生具有分析和解决问题的能力,综合性很强,难度中等.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有NA个分子 | |
| B. | 1L 1mol•L -1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
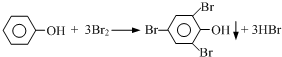
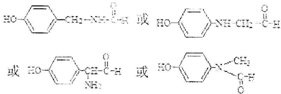
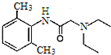 )是一种局部麻醉药物,可由下列路线合成:
)是一种局部麻醉药物,可由下列路线合成: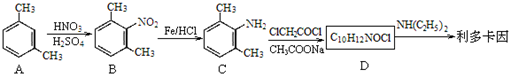
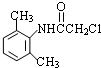 .
.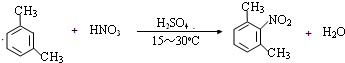 .
. .
.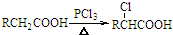 ,写出以苯和乙醇为原料制备
,写出以苯和乙醇为原料制备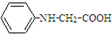 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、SO32-、MnO4- | |
| B. | pH=7的溶液中:Na+、Al3+、Cl-、SO42- | |
| C. | pH>12的溶液中:Na+、K+、SO42-、AlO2- | |
| D. | pH=0的溶液中:Na+、K+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氧化物不能与任何酸发生反应 | |
| B. | X和W可形成离子化合物 | |
| C. | X、Y、Z和W都没有同素异形体 | |
| D. | Z和W的最高价氧化物对应的水化物都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 结论 |
| A | 配制FeCl2溶液时加入适量的盐酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层. |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,平衡向正反应方向移动 | |
| C. | 当进行4分钟时,反应已达平衡状态 | |
| D. | 其他条件不变,通过缩小容器体积增大压强,平衡常数减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com