



 ,。
,。 则晶胞的体积是d3,则p·d3=(4×64)/NA解得p=
则晶胞的体积是d3,则p·d3=(4×64)/NA解得p= .
.

科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
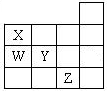
| A.与氢原子形成的化学键的键能:W比Y的大 |
| B.与氢原子形成的化学键的极性:X比Y的弱 |
| C.最低价气态氢化物的沸点:X的比W的高 |
| D.XZ3的晶体属于离子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



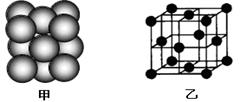
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道 |
| C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素 |
| D.SO42-与PO43-互为等电子体,空间构型均为正四面体 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 该配离子中含有的化学键类型有 (填字母编号)。
该配离子中含有的化学键类型有 (填字母编号)。 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com