
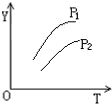
 对于密闭容器中的可逆反应:4L(g)?2M(g)+N(g)△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示.图中y轴是指( )
对于密闭容器中的可逆反应:4L(g)?2M(g)+N(g)△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示.图中y轴是指( )| A、气体混合物的平均相对分子质量 |
| B、气体混合物的总物质的量浓度 |
| C、L在气体混合物的体积分数 |
| D、气体混合物的密度 |


科目:高中化学 来源: 题型:
| A、用激光笔检验某KI溶液中是否溶有淀粉 |
| B、配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗 |
| C、向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp(AgI) |
| D、配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4和C2H4 |
| B、CH4和C3H4 |
| C、C2H2和C3H6 |
| D、C2H4和C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

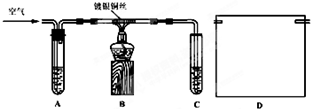
| A、装置①可用于除去Cl2中含有的少量HCl气体 |
| B、按装置②所示的气流方向可用于收集H2、NH3等 |
| C、装置③可证明非金属性Cl>C>Si |
| D、装置④向左推动针筒活塞可检验该装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
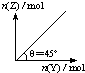 在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通入Y气体,发生反应:X(s)+aY(g)?bZ(g)+W(g);△H>0平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示.下列说法中正确的是( )
在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通入Y气体,发生反应:X(s)+aY(g)?bZ(g)+W(g);△H>0平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示.下列说法中正确的是( )A、平衡时Y的转化率为
| ||
| B、向容器中再加入少量X,则Y的转化率增大 | ||
| C、再通入Y,重新达到平衡时W的体积分数不变 | ||
| D、保持压强一定,当原反应在较高温度下建立平衡时,图中θ<45° |
查看答案和解析>>
科目:高中化学 来源: 题型:
. |
| M |
A、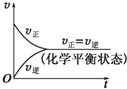 |
B、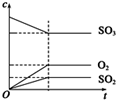 |
C、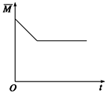 |
D、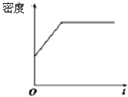 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、Na2SiO3是制备硅胶和木材防火剂的原料 |
| C、食盐可作调味剂,不可作防腐剂 |
| D、合金的硬度大,熔点也高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:用惰性电极电解某盐X的溶液,发生的反应为:X+H2O
已知:用惰性电极电解某盐X的溶液,发生的反应为:X+H2O| 电解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com