
 已知:用惰性电极电解某盐X的溶液,发生的反应为:X+H2O
已知:用惰性电极电解某盐X的溶液,发生的反应为:X+H2O| 电解 |
| ||
| ||
| 27g |
| 108g/mol |
| 0.25mol |
| 4 |
| 1 |
| 16 |
| 1 |
| 16 |


 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
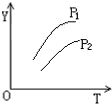 对于密闭容器中的可逆反应:4L(g)?2M(g)+N(g)△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示.图中y轴是指( )
对于密闭容器中的可逆反应:4L(g)?2M(g)+N(g)△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示.图中y轴是指( )| A、气体混合物的平均相对分子质量 |
| B、气体混合物的总物质的量浓度 |
| C、L在气体混合物的体积分数 |
| D、气体混合物的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
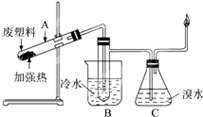 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如下表
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如下表| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,有白色沉淀产生,说明蛋白质发生了变性 |
| B、棉花、纸、醋酸纤维的主要成分都是纤维素 |
| C、淀粉、牛油、蛋白质都是天然高分子化合物 |
| D、油脂里饱和烃基的相对含量越大,油脂的熔点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 :
: +H2O
+H2O| H+ |
| △ |
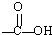 +
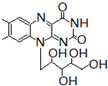
+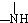 有关核黄素的下列说法中,不正确的是( )
有关核黄素的下列说法中,不正确的是( )| A、该化合物的分子式为C17H22N4O6 |
| B、酸性条件下加热水解,有CO2生成 |
| C、酸性条件下加热水解,所得溶液加碱后有NH3生成 |
| D、能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2和O3互为同位素 |
| B、O2和O3的相互转化是物理变化 |
| C、在相同的温度与压强下,等体积的O2和O3含有相同的分子数 |
| D、等物质的量的O2和O3含有相同的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
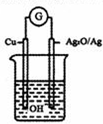 普通水泥在固化过程中自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法正确的是( )| A、铜电极附近有黑色沉淀生成 |
| B、负极的电极反应式为2Cu+2OH--2e-═Cu2O+H2O |
| C、测量原理示意图中,电流方向从Cu经过导线流向Ag2O |
| D、电池工作时,溶液中OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B、依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯 |
| C、依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D、依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、转移的电子数是1.204×1022 |
| B、阳极上产生112mLO2(标准状况) |
| C、溶液的浓度变化为0.08mol?L-1 |
| D、反应中有0.01molAg被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com