
 已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol
已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol| t(min) n(mol) 物质 | 0 | 2 | 4 | 6 | 8 | 10 |
| H2 | 0 | 0.174 | 0.224 | 0.244 | 0.244 | 0.244 |
| I2 | 0 | 0.174 | 0.224 | 0.244 | 0.244 | 0.244 |
| HI | 2 | 1.652 | 1.552 | 1.512 | 1.512 | 1.512 |
| 2-1.552 |
| 2 |
| (2-1.552)mol |
| 2L |
| 0.224mol/L |
| 4min |
| C2(HI) |
| C(H2)C(I2) |
| C2(HI) |
| C(H2)C(I2) |
| 2-1.552 |
| 2 |


科目:高中化学 来源: 题型:
| A、Ba(OH)2和Ba(HCO3)2 |
| B、AlCl3和NaOH |
| C、NaAlO2和H2SO4 |
| D、Ba(OH)2和NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将2mol/L NaAlO2溶液和3mol/L的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
| B、向1mol/L明矾溶液50mL中滴入数滴0.1mol/L Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| D、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧SO3 | ⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
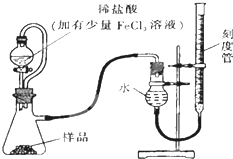 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)={c(CO32-)+c(HCO3-)+c(H2CO3)} |
| C、c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷与NaOH醇溶液共热 |
| B、一氯甲烷与NaOH醇溶液共热 |
| C、溴乙烷与NaOH水溶液共热 |
| D、乙醇与浓硫酸共热至170℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com