
| A、中子数 |
| B、核电荷数 |
| C、核外电子数 |
| D、在周期表中的位置 |


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO是强酸 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、Fe在足量Cl2中燃烧只生成FeCl3 |
| D、二氧化硅是将太阳能转化为电能的常用材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(5a-2b) kJ |
| B、(4b-10a) kJ |
| C、(5a+2b) kJ |
| D、(10a+4b) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
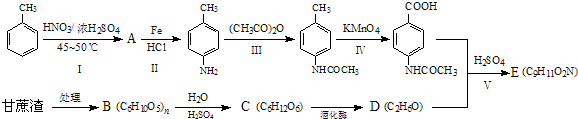
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol
已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol| t(min) n(mol) 物质 | 0 | 2 | 4 | 6 | 8 | 10 |
| H2 | 0 | 0.174 | 0.224 | 0.244 | 0.244 | 0.244 |
| I2 | 0 | 0.174 | 0.224 | 0.244 | 0.244 | 0.244 |
| HI | 2 | 1.652 | 1.552 | 1.512 | 1.512 | 1.512 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 三氯化铁是中学化学实验室中不可缺少的重要试剂.
三氯化铁是中学化学实验室中不可缺少的重要试剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com