
����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��������������ij�������Ƹ﹤ҵ������Cr(��)�Ĵ��������������£�
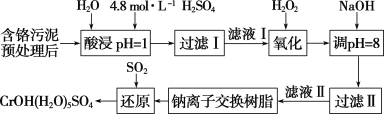
��֪�����ȡҺ�еĽ���������Ҫ��Cr3���������Fe3����Al3����Ca2����Mg2���ȡ�
��1������500mL4.8mol/L��ϡ������Һ����Ҫ�IJ����������ձ����������⣬����Ҫ______��
��2�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��________��________��(�������)
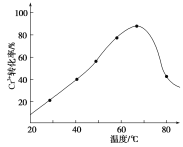
��3��H2O2�������ǽ���Һ���е�Cr3��ת��ΪCr2O![]() ����˷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________�����������������䣬��Ӧ�¶ȶ�Cr3��ת���ʵ�Ӱ����ͼ��ʾ��������¶ȳ���70 ��ʱ��Cr3��ת�����½���ԭ����__________��
����˷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________�����������������䣬��Ӧ�¶ȶ�Cr3��ת���ʵ�Ӱ����ͼ��ʾ��������¶ȳ���70 ��ʱ��Cr3��ת�����½���ԭ����__________��
��4�������£�����������������������ʽ����ʱ��Һ��pH���£�
������ | Fe3�� | Al3�� | Cr3�� |
��ʼ����ʱ��pH | 2.7 | �� | �� |
������ȫʱ��pH | 3.7 | 5.4(��8�ܽ�) | 9(��9�ܽ�) |
����NaOH������Һ��pH���ܳ���8����������_________��
�ڵ�pH��8ʱ��Mg2���Ƿ�ʼ����(��Һ��þ����Ũ��ԼΪ1 mol��L��1)________(�� ��������������)����֪Ksp[Mg(OH)2]��1.8��10��11��
��5�����������У�����NaOH��Һ����Һ�ʼ��ԣ�Cr2O72-ת��ΪCrO42-��д��������������SO2���л�ԭ��Ӧ����CrOH(H2O)5SO4���������ӷ���ʽ _________��
��6��Cr(OH)3��Al(OH)3���ƣ�Ҳ�������������д����CrCl3��Һ����μ�NaOH��Һ�����������ӷ���ʽ_____________��
���𰸡�500moL����ƿ������ι� �ʵ������¶�(����) ���� 3��2 ˫��ˮ�ڽϸ��¶��·����ֽ⣬Ũ�Ƚ��� pH����8��ʹ����Al(OH)3�ܽ�����AlO2-������Ӱ��Cr������������ �� 3SO2��2CrO42-��12H2O=2CrOH(H2O)5SO4����SO42-��2OH�� Cr3+��3OH�� = Cr(OH)3��
Cr(OH)3��OH��= [Cr(OH)4]�� �ۻ�Cr(OH)3��OH��= CrO2����2H2O��
��������
��������Ԥ�������������ȡҺ�н���������Ҫ��Cr3+�������Fe3+��Al3+��Ca2+��Mg2+�����������������������Ϊ��̬����������������Һ������ҺpH=8ʹ�������ӳ��������˵õ���Һ�������ӽ�����֬����þ���Ӻ����ӣ��õ� ��Һ��ͨ���������ԭ�õ�CrOH(H2O)5SO4���ݴ˷�����
��1������һ�����ʵ���Ũ�ȵ���Һ����IJ��������У��ձ����������������ܡ�����ƿ�ͽ�ͷ�ιܣ��ʴ�Ϊ��500mL����ƿ����ͷ�ιܣ�
��2�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ�ǣ��ʵ������¶�(����)�����裻
��3��˫��ˮ��ǿ�����ԣ���������ԭ�Ե����ʣ�Cr3+�л�ԭ�ԣ�Cr3+�ܱ�˫��ˮ����Ϊ�����ӣ��Ա������������ӷ��룬��Ӧ�����ӷ���Ϊ��2Cr3++3H2O2+H2O=Cr2O72-+8H+����Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ3��2��
�¶����߳���70��ʱ��������ֽ⣬ʹƽ��������У�Cr������ת�����½����ʴ�Ϊ���ϸ��¶���˫��ˮ�ֽ⣻
��4���ٳ���pH=8��������������������������ܽ���ǿ����Һ��Ӱ������ӵĻ������ã������ӽ�����֬�����������Ǹ����Ӻ�þ���ӣ�
�ڵ�pH=8ʱ��c(Mg2+)c2(OH-)=(Ksp[Mg(OH)2]=1. 8��10-11��c(Mg2+)=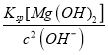 =
=![]() =18mol/L, ��Һ��þ����Ũ�Ȳ�����1mol��L-1����ˣ���ʱMg2+��������
=18mol/L, ��Һ��þ����Ũ�Ȳ�����1mol��L-1����ˣ���ʱMg2+��������
��5���������̿�֪����SO2���л�ԭCrO42-��������Ӧ����CrOH(H2O)5SO4���������ӷ���ʽΪ3SO2��2CrO42-��12H2O=2CrOH(H2O)5SO4����SO42-��2OH����
��6��Cr(OH)3��Al(OH)3���ƣ�Ҳ���������������CrCl3��Һ����μ�NaOH��Һ�����������ӷ���ʽΪCr3+��3OH�� = Cr(OH)3����Cr(OH)3��OH��= [Cr(OH)4]�� �ۻ�Cr(OH)3��OH��= CrO2����2H2O�ݡ�


 ֥�鿪���γ�������ϵ�д�
֥�鿪���γ�������ϵ�д� ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ���NaBr��ŨH2SO4���Ҵ�Ϊԭ���Ʊ����������飺
C2H5��OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
��֪��Ӧ�������Ϊ��0.30 mol NaBr��s����0.25 mol C2H5OH���ܶ�Ϊ0.80 g��cm-3����36 mLŨH2SO4����������Ϊ98%���ܶ�Ϊ1.84 g��mL-1����25 mLˮ���Իش��������⡣
��1����ʵ��Ӧѡ��ͼ�е�aװ�û���bװ�ã�_____________��
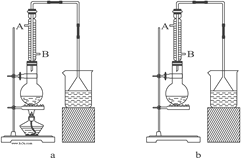
��2����Ӧװ���е���ƿӦѡ���������ֹ���������_____��
A.50 mL B.100 mL C.150 mL D.250 mL
��3���������е�����ˮ������Ӧ����_____��
A. A��B�� B. B��A�� C. ��A����B������
��4�����ܷ����ĸ���ӦΪ��_____________��__________��______________������д��3������ʽ����
��5��ʵ����ɺ��뽫��ƿ�ڵ��л�������������õ��ػ�ɫ�Ĵ������飬���ô��������飬Ӧ���õĴ�ʩ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᱵ�����ȶ��Ժã���糣���ߣ���С�ͱ�ѹ������Ͳ���������ж���Ӧ�á����ᱵ����ľ����ṹʾ��ͼ��ͼ��ʾ�����Ļ�ѧʽ��
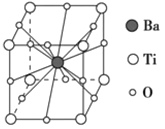
A. BaTi8O12
B. BaTiO3
C. BaTi2O4
D. BaTi4O6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��200�桢101kPaʱ�����ܱ������г���1molH2��1molI2��������ӦI2(g)+H2(g)![]() 2HI(g) ��H=��14.9 kJ/mol����Ӧһ��ʱ�����˵����Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
2HI(g) ��H=��14.9 kJ/mol����Ӧһ��ʱ�����˵����Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
A. �ų�������С��14.9 kJ
B. ��Ӧ������ѹǿ���ٱ仯
C. HI���ɵ�������HI�ֽ���������
D. ��λʱ��������a mol H2��ͬʱ����2a mol HI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾһЩ�����е�ijЩ�ṹ����ش��������⣺
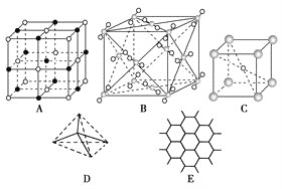
��1���������ʯ����(������ĸ����ͬ)___������ÿ��̼ԭ����____��̼ԭ������Ҿ�����ȡ����ʯ����____���塣
��2������ʯī����____��ÿ����������ռ�е�̼ԭ����ƽ��Ϊ____����
��3������NaCl����___��ÿ��Na����Χ��������Ҿ�����ȵ�Na����___����
��4������CsCl����___��������____���壬ÿ��Cs����____��Cl�����ڡ�
��5�������ɱ�����___��������___���壬ÿ��CO2������___��CO2���ӽ��ڡ�
��6����֪ʯī��̼̼���ļ����Ƚ��ʯ��̼̼���ļ����̣����������������۵��ɸߵ��͵�����˳��Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2��Ư��Һ(��Ч�ɷ�Ϊ NaClO)�������������й㷺����ɱ����������
(1)��� NaCl ��Һ����Cl2�Ļ�ѧ����ʽ��________________��
(2)Cl2����H2O��NaOH ��Һ�������ˮ��Ư��Һ��
�ٸ������������Ư�����ʣ�����ˮȴ��Ư�����ã�˵����Ư�����õ�������_____��
��25����Cl2��H2O��NaOH �ķ�Ӧ���£�
��Ӧ�� | Cl2+H2O |
��Ӧ�� | Cl2+2OH- |
���Ͳ�ֱ��ʹ����ˮ��ʹ��Ư��Һ����������ԭ��_____��
(3)��ͥʹ��Ư��Һʱ������ֱ�ӽӴ�����Ʒ��Ư��Һ��ʴ���ĵ缫��ӦΪ��Fe-2e-=Fe2+��ClO-�����ĵ缫��ӦʽΪ____________��
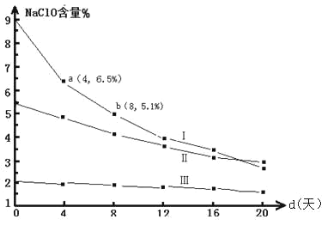
(4)�о�Ư��Һ���ȶ��Զ��������ͱ�����ʵ�����塣30��ʱ��pH=11 ��Ư��Һ��NaClO �������ٷֺ�����ʱ��仯���£�
�ȽϷֽ����� v(I)�� v(II)�Ĵ�С��ϵ_____��ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ӧ�ﵽ��ѧƽ�⣬��ѹ���¶���ʹ��ѧƽ�����淴Ӧ�����ƶ�����
A. 2NO2![]() N2O4������ӦΪ���ȷ�Ӧ�� B. C��s��+CO2
N2O4������ӦΪ���ȷ�Ӧ�� B. C��s��+CO2![]() 2CO������ӦΪ���ȷ�Ӧ��
2CO������ӦΪ���ȷ�Ӧ��
C. N2+3H2![]() 2NH3������ӦΪ���ȷ�Ӧ�� D. H2S
2NH3������ӦΪ���ȷ�Ӧ�� D. H2S![]() H2+S��s��������ӦΪ���ȷ�Ӧ��
H2+S��s��������ӦΪ���ȷ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ����㷺�Ľ���������±����������Լ������ĺ������ξ�Ϊ��Ҫ�����
��1����Ԫ�������ڱ��е�λ��Ϊ_______��
��2��Ҫȷ������ij�Ȼ���FeClx�Ļ�ѧʽ�����������ӽ����͵ζ��ķ�����ʵ���г�ȡ0.54 g��FeClx��Ʒ���ܽ���Ƚ��������ӽ���Ԥ��������ͨ�����б���OH���������ӽ�������ʹCl����OH������������������ɺ�������Һ��OH����0.40 mol��L��1������ζ��������յ�ʱ��������25.0 mL����x=_____��
��3��ʵ���������軯��ȷ��ij�����Ȼ������Ƿ���FeCl2���÷�Ӧ�����ӷ���ʽΪ_____��
��4��Fe(OH)3����������ᷴӦʱ��������ɫ���ʵ����ӷ���ʽΪ________��
��5���������(K2FeO4)��һ��ǿ������������Ϊˮ��������������ز��ϡ�FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4���䷴Ӧ�����ӷ���ʽΪ_______��
��6��ʵ����ȷ��ȡ1.44g�����������壬�ڿ��������գ��õ�0.773g���������д��������������Ļ�ѧʽ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߷��� PVA �������Ƶ���¶Һ�������Ƴ��˹���Ĥ��ҽ�Ʋ�Ʒ���ɵ�ʯ(CaC2)�ϳ� PVA �Ĺ������£�
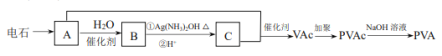
��֪��VAc �Ľṹ��ʽΪ CH3COOCH=CH2 ��
(1)��ʯ�Ʊ� A �Ļ�ѧ����ʽ��_________________��
(2)B ��������Һ��Ӧ�Ļ�ѧ����ʽ��_________________��
(3)PVA �Ľṹ��ʽ��__________________��
(4)����ϩ����������Ľṹ��ʽΪ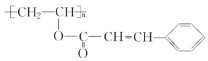 ������һ�ָй��Ը߷�����֬���䵥����� A �������(
������һ�ָй��Ը߷�����֬���䵥����� A �������( ![]() )�ϳɣ��÷�Ӧ�Ļ�ѧ����ʽ��________________________________��
)�ϳɣ��÷�Ӧ�Ļ�ѧ����ʽ��________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com