
【题目】某课外活动小组利用如图1装置进行乙醇的催化氧化实验并制取乙醛(试管丁中用水吸收产物),图中铁架台等装置已略去,实验时,先加热玻璃管中的镀银铜丝,约lmin后鼓入空气,请填写下列空白:

(1)检验乙醛的试剂是__;
A、银氨溶液 B、碳酸氢钠溶液 C、新制氢氧化铜 D、氧化铜
(2)乙醇发生催化氧化的化学反应方程式为____________;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是_____________,由于装置设计上的陷,实验进行时可能会____________;
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行,进一步研究表明,鼓气速度与反应体系的温度关系曲线如图2所示,试解释鼓气速度过快,反应体系温度反而下降的原因________,该实验中“鼓气速度”这一变量你认为__________________可用来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色,该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应,请你设计一个简单的实验,探究哪一种猜想正确______________________________?
【答案】 AC 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 使生成乙醇蒸气的速率加快且较均匀 发生倒吸 鼓气多反应放热多,过量的气体会将体系中的热量带走 单位时间内甲中的气泡数 用pH试纸检测溴水与褪色后溶液的酸碱性:若酸性明显增强,则猜想①正确;若酸性明显减弱,则猜想②正确
2CH3CHO+2H2O 使生成乙醇蒸气的速率加快且较均匀 发生倒吸 鼓气多反应放热多,过量的气体会将体系中的热量带走 单位时间内甲中的气泡数 用pH试纸检测溴水与褪色后溶液的酸碱性:若酸性明显增强,则猜想①正确;若酸性明显减弱,则猜想②正确
【解析】(1)乙醛分子中含有醛基,能够与银氨溶液发生银镜反应,可以用银氨溶液检验乙醛;乙醛也能够与新制的氢氧化铜浊液反应,所以可用银氨溶液或新制氢氧化铜检验乙醛;
(2)乙醇在通作催化剂时,可以被氧气氧化为乙醛,反应的方程式为: 2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)将甲装置浸在70℃~80℃的水浴中,使生成乙醇蒸气的速率加快且较均匀,导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水而使丙装置产生倒吸现象;
(4)反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,实验中“鼓气速度”这一变量可通过观察甲中冒气泡的速度看出来;
(5)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性,乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应。
详解:(1)乙醛分子中含有醛基,能够与银氨溶液发生银镜反应,可以用银氨溶液检验乙醛;乙醛也能够与新制的氢氧化铜浊液反应,所以可用银氨溶液或新制氢氧化铜检验乙醛,即A、C正确,
因此,本题正确答案是:AC;
(2)乙醇在通作催化剂时,可以被氧气氧化为乙醛,反应的方程式为: 2CH3CH2OH+O2![]() 2CH3CHO+2H2O,
2CH3CHO+2H2O,
因此,本题正确答案是: 2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)将甲装置浸在70℃~80℃的水浴中,使生成乙醇蒸气的速率加快且较均匀,导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水而使丙装置产生倒吸现象,
因此,本题正确答案是:使生成乙醇蒸气的速率加快且较均匀;发生倒吸;
(4)反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,实验中“鼓气速度”这一变量可通过观察甲中冒气泡的速度看出来,
因此,本题正确答案是:鼓气多反应放热多,过量的气体会将体系中的热量带走;单位时间内甲中的气泡数;
(5)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性,乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应,
因此,本题正确答案是:用pH试纸检测溴水与褪色后溶液的酸碱性:若酸性明显增强,则猜想(1)正确;若酸性明显减弱,则猜想(2)正确。


科目:高中化学 来源: 题型:
【题目】某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是__;
(2)已知:
ⅰ.![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.![]()
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去.

请回答:
①步骤Ⅰ的目的是__;
②若G为气体,且相对分子质量是44,则E的结构简式是__;E的核磁共振氢谱中有__个吸收峰(填数字);
③F→H的反应类型是__;
④F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式__;
⑤A的结构简式是__;
上述转化中B→D的化学方程式是__;
(3)已知A的某种同分异构体K具有如下性质:
①K与FeCl3反应,溶液呈紫色
②K在一定条件下可发生银镜反应
③K分子中苯环上的取代基上无甲基
请写出K所有可能的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是短周期元素,在元素周期表中的位置如图所示,下列有关说法正确的是( )

A. 原子半径:Z>Y>X
B. 氢化物的稳定性:X>Y、Z>Y
C. 最高价氧化物对应的水化物酸性:Y>X
D. 三种元素形成的简单离子的半径:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化是人类文明的瑰宝,古代文献中记载了大量古代化学的研究成果。回答下面问题。
(1)我国最原始的陶瓷约出现在距今12000年前,制作瓷器所用的原料是高岭士,其晶体化学式是Al4[Si4O10](OH)8,用氧化物表示其组成为____。
(2)《本草纲目》中记载:“(火药)乃焰消( KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”反应原理为:S+2KNO3+3C![]() K2S+N2↑+2CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
K2S+N2↑+2CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
(3)我国古代中药学著作《新修本草》记载的药物有844种,其中有关“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”我国早期科技丛书《物理小适-金石类》 记载有加热青矾时的景象:“青矾厂气熏人,衣服当之易烂,载木不盛。”青矾就是绿矾( FeSO4·7H2O)。根据以上信息,写出“青矾”受热分解的化学方程式____
(4)中国古代第一部药物学专著《神农本革经》记载:“石硫磺(S)…主阴蚀疽痔恶血,坚筋骨,除头秃,能化金银铜铁奇物。”根据以上信息,得出硫磺(S)具有的性质或用途是 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
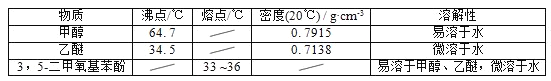
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________________________。
(2)已知反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为____________,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 ___________。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_____________________,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=_________(溶液电解前后体积的变化忽略不计)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化碘的化学式为ICl,性质和溴非常相似。下列关于ICl的有关说法中不正确的是( )
A. I与Cl之间形成的化学键为共价键
B. ICl分子为共价化合物分子
C. 该物质在反应中通常体现氧化性
D. ICl在反应ICl+2NaOH![]() NaCl+NaIO+H2O中作氧化剂
NaCl+NaIO+H2O中作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.铜的化学性质活泼,不宜用铜制作盛食品的器皿
B.铜的导电能力不如铝
C.由于Cu2+有氧化性,所以用CuSO4来配制农药
D.因为Cu2+能使蛋白质变性,所以铜盐溶液有毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com