
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
【答案】D
【解析】该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为![]() 、正极反应式为O2+4e-+2H2O ==4OH―;从以上分析可以知道原电池反应,铁做负极被腐蚀,碳做正极,A错误;原电池中电子沿外导线从负极流向正极,不能通过电解质溶液,电解质溶液中是离子的定向移动形成闭合回路,B错误;正极电极反应是溶液中氧气得到电子发生还原反应,电极反应O2+4e-+2H2O ==4OH―,C错误;负极反应式为
、正极反应式为O2+4e-+2H2O ==4OH―;从以上分析可以知道原电池反应,铁做负极被腐蚀,碳做正极,A错误;原电池中电子沿外导线从负极流向正极,不能通过电解质溶液,电解质溶液中是离子的定向移动形成闭合回路,B错误;正极电极反应是溶液中氧气得到电子发生还原反应,电极反应O2+4e-+2H2O ==4OH―,C错误;负极反应式为![]() 、正极反应式为O2+4e-+2H2O ==4OH―,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,离子反应方程式为
、正极反应式为O2+4e-+2H2O ==4OH―,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,离子反应方程式为![]() 、化学方程式为
、化学方程式为![]() ,每生成
,每生成![]() 铁锈
铁锈![]() ,铁元素为2mol,根据铁元素守恒计算:2Fe -O2 2Fe(OH)24e- 根据上述反应关系可知,2molFe参加反应消耗氧气1mol,生成Fe(OH)2为2mol,再根据4Fe(OH)2O2关系可知,消耗2mol Fe(OH)2,消耗氧气为0.5 mol,理论上消耗标准状况下的氧气体积(1+0.5)×22.4=33.6L,D正确;正确选项D。
,铁元素为2mol,根据铁元素守恒计算:2Fe -O2 2Fe(OH)24e- 根据上述反应关系可知,2molFe参加反应消耗氧气1mol,生成Fe(OH)2为2mol,再根据4Fe(OH)2O2关系可知,消耗2mol Fe(OH)2,消耗氧气为0.5 mol,理论上消耗标准状况下的氧气体积(1+0.5)×22.4=33.6L,D正确;正确选项D。


科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是
A. 中和反应是吸热反应 B. 燃烧属于放热反应
C. 化学键断裂放出能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成神经抑制剂F的一种路线如图所示:
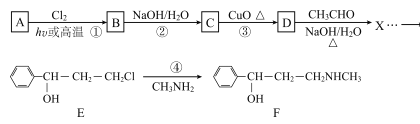
已知:![]()
请回答下列问题:
(1)已知芳香烃A的相对分子质量为92,A的结构简式为____;B的系统命名是___ ;C中含氧官能团的名称是____。
(2)反应③的化学反应方程式为____;①~④中属于取代反应的是____。
(3)D分子中最多有____个原子共平面。
(4)④的反应中,因反应温度控制不当,常常有副产物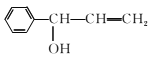 生成,写出可能的副反应方程式____。
生成,写出可能的副反应方程式____。
(5)包含C在内,C的同分异构体中芳香族化合物共有____种,其中满足下列条件同分异构体的结构简式为____。
①能使FeCl3溶液显色,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1。
(6)已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备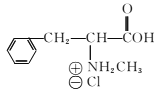 的合成路线(无机试剂自选):________________________________________
的合成路线(无机试剂自选):________________________________________
流程示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.离子键就是使阴、阳离子通过共用电子对而形成的
B.只有活泼金属与活泼非金属之间才能形成离子键
C.离子化合物受热熔化时可以导电
D.离子化合物溶解时,离子键不被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是
A. 体积大小: ④>③>②>① B. 原子数目: ③>①>④>②
C. 密度大小: ④>②>③>① D. 质量大小: ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。

(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
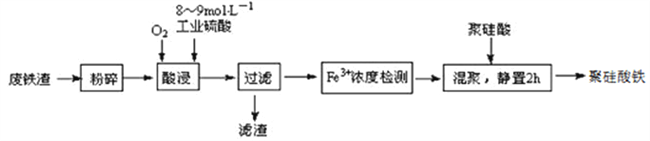
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com