
����Ŀ��ij����С�����þ��CO2�ķ�Ӧ���ʵ��̽��þ��NO2�ķ�Ӧ��
��ͬѧ�Ʋ������MgO��N2��
��ͬѧ�Ʋ�������MgO��N2�⣬�����л����ܺ���Y��
��С��ͬѧ���������װ��̽��þ��NO2��Ӧ�Ĺ��������ⶨ����ɡ�

��1��ʵ�鿪ʼʱ���ȹر�ֹˮ�к���ɼУ��ٴ�Һ©����������Ӳ�ʲ����ܳ�������ɫ�����ֹˮ�У��رյ��ɼУ�����ȼ�ƾ��ơ���������Ŀ����___________________________________________________________
��2��װ��B�е��Լ�����ѡ��________
A��Ũ���� B����ˮ�Ȼ��� C������������ D����ʯ��
��3��װ��C��ʢװ����������Һ�������ǣ�___________________________________
��4��Ϊ��֤�������������ȷ�ԣ���ȡ��Ͳ�̶�ʱӦע��������Ǣ�����ָ��������ٶ�������_______________________________����______________________________��
��5��ʵ���������ͬѧ�ǽ��������ȡ����ˮ��Ӧ�������д̼�����ζ�������������������ʹʪ���ʯ����ֽ������˵������ͬѧ�Ʋ���ȷ����д��Y��ˮ��Ӧ�Ļ�ѧ����ʽ__________________________________
��6������ʼ����þ������Ϊ3.6 g����������NO2�г�ַ�Ӧ�� ���ռ���N2���Ϊ448mL (��״��)���������MgO��������_________
���𰸡� �ų�װ���п���������������� BC ����ʣ��NO2 ������Ͳ��Һ����D��ˮƽ ������Һ�尼Һ������ Mg3N2+H2O=3Mg(OH)2��+2NH3�� 4.8g
��������(1)ʵ�鿪ʼʱ���ȹر�ֹˮ�к���ɼУ��ٴ�Һ©����������Ӳ�ʲ����ܳ�������ɫ�����ֹˮ�У��رյ��ɼУ�����ȼ�ƾ��ơ������������ų�װ���п���������������ţ��ʴ�Ϊ���ų�װ���п���������������ţ�
(2)װ��A��Ũ������ͭ��Ӧ���ɶ������������ɵĶ��������л���ˮ������װ��B�е��Լ���Ҫ��ȥ���е�ˮ����������ѡ����ˮ�Ȼ��ƺ��������������Թ�����������ѡBC��
(3)���������ܹ���Ⱦ������������ˮ��Ӧ����һ��������Ӱ�쵪��������IJⶨ��װ��C��ʢװ����������Һ��������Ϊ��Ӧ��NO2���ʴ�Ϊ������ʣ���NO2��
(4)Ϊ��֤�������������ȷ�ԣ���ȡ��Ͳ�̶�ʱӦע��������ǣ�������ָ��������ٶ������ڵ�����Ͳ��Һ����D��ˮƽ����������Һ�尼Һ�����У��ʴ�Ϊ��������Ͳ��Һ����D��ˮƽ��������Һ�尼Һ�����У�
(5)ʵ�������ͬѧ�ǽ��������ȡ����ˮ��Ӧ�������д̼�����ζ�������������������ʹʪ���ʯ����ֽ������˵�����ɵ�����Ϊ���������������к��е�Ԫ�أ����ݲ��뷴Ӧ������Ϊþ�Ͷ��������������жϹ������ΪMg3N2��Mg3N2��ˮ��Ӧ�Ļ�ѧ����ʽΪMg3N2+H2O=3Mg(OH)2��+2NH3�����ʴ�Ϊ��Mg3N2+H2O=3Mg(OH)2��+2NH3����
(6)þ�����ʵ���=![]() =0.15mol����Ӧ��������þ��þ��ʧȥ����0.3mol����״���£�N2���Ϊ448mL�����ʵ���=
=0.15mol����Ӧ��������þ��þ��ʧȥ����0.3mol����״���£�N2���Ϊ448mL�����ʵ���=![]() =0.02mol���õ��˵���0.02mol��8=0.16mol�����ݵ�ʧ�����غ㣬����Mg3N2
=0.02mol���õ��˵���0.02mol��8=0.16mol�����ݵ�ʧ�����غ㣬����Mg3N2![]() mol=0.01mol������þԭ���غ㣬���ɵ�����þΪ
mol=0.01mol������þԭ���غ㣬���ɵ�����þΪ![]() mol=0.12mol������Ϊ0.12mol��40g/mol=4.8g���ʴ�Ϊ��4.8g��
mol=0.12mol������Ϊ0.12mol��40g/mol=4.8g���ʴ�Ϊ��4.8g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�ã�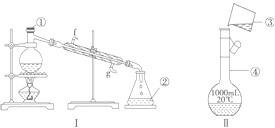
��1��д���������������ƣ��� �� ��_���� ��
��2��������װ�â�������Ȼ�̼�;ƾ��Ļ�����ȱ�ٵ������� �� ������������������е�ʵ�����������Ϊ�������ܵĽ�ˮ�������f����g��������������250mL 0.2mol/L NaCl��Һ��װ�â���ijͬѧת����Һ��ʾ��ͼ��ͼ�еĴ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Na2O��˵��������ȷ����
A.���ڼ���������B.����ˮ��Ӧ���ɶ�Ӧ�ļ�
C.�����ᷴӦ�����κ�ˮD.����CO2��Ӧ�����κ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��10.8gij�л���A�ڴ�������ȫȼ�գ������ɶ�����̼30.8g��ˮ7.2g�������ⶨ���л���A��Է�������Ϊ108��
��1������л���A�ķ���ʽ��
��2�������л���A��FeCl3��Һ��������ɫ�����л���A����ˮ��Ӧ��1mol �л���A����3mol�嵥�ʣ�д�����л���A�Ľṹ��ʽ�Լ�A����ˮ��Ӧ�Ļ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ɴ�����Ⱦ����Ҫ���ʡ��о���������ķ�Ӧ��������������������Ⱦ����Ҫ���塣�ش�����������
��1����֪2NO(g) +O2(g)![]() -2NO2(g) ��H�ķ�Ӧ���̷�������
-2NO2(g) ��H�ķ�Ӧ���̷�������
��2NO( g )![]() N2O2 (g)( �� ) ��H1<0��v1��=k1��c2(NO)��v1��=k1��c2(N2O2)
N2O2 (g)( �� ) ��H1<0��v1��=k1��c2(NO)��v1��=k1��c2(N2O2)
��N2O2 (g)+ O2 (g) ![]() 2NO2(g)(��) ��H2<0��v2��=k2��c2(N2O2)c(O2)��v2��=k2��c2(NO2)
2NO2(g)(��) ��H2<0��v2��=k2��c2(N2O2)c(O2)��v2��=k2��c2(NO2)
�ȽϷ�Ӧ���Ļ��E1�뷴Ӧ���Ļ��E2�Ĵ�С: E1__ E2 (����>������<������=��) ���ж�������__________��2NO(g) +O2(g)![]() 2NO2(g) ��ƽ�ⳣ��K��������Ӧ���ʳ���k1����k1����k2���� k2���Ĺ�ϵʽΪ_______����֪��Ӧ���ʳ���k���¶����߶������������¶Ⱥ�k2���� k2���ֱ�����a����b������a____b (����>������<������=��)��һ�������£�2NO (g)+O2(g)
2NO2(g) ��ƽ�ⳣ��K��������Ӧ���ʳ���k1����k1����k2���� k2���Ĺ�ϵʽΪ_______����֪��Ӧ���ʳ���k���¶����߶������������¶Ⱥ�k2���� k2���ֱ�����a����b������a____b (����>������<������=��)��һ�������£�2NO (g)+O2(g) ![]() 2NO2 (g)��ƽ������ߵ�ij�¶ȣ��ٴ�ƽ���v2����ԭƽ���С�������������ʷ��̷����������Ľ�����_________________��
2NO2 (g)��ƽ������ߵ�ij�¶ȣ��ٴ�ƽ���v2����ԭƽ���С�������������ʷ��̷����������Ľ�����_________________��
��2��������ϩ(C2H4)��Ϊ��ԭ������(NO)������������������ͼ��ʾ������Ӧ��n(NO): n(O2) =2 ��1�����ܷ�Ӧ�Ļ�ѧ����ʽΪ_______________�����������¶ȡ�������(����ɸ�д�������������) �Ĺ�ϵ������ͼ��Ϊ�ﵽ�������Ч����Ӧ���õ�������________________��
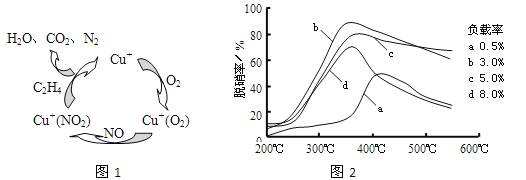
����NO��ֱ�Ӵ�NO�ֽ�����N2��O2�����䷴Ӧ������������(Vo��������Ѩ)��
2Ni2++2Vo+2NO��2Ni3++2O-+N2 2O-��O2-+1/2O2+Vo ______________
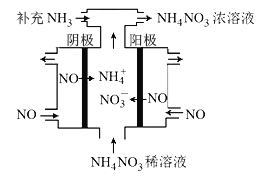
��3�����NO���Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ�������ĵ缫��ӦʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϯ��������G�л��ϳɡ�ҩ��²��ϵȷ����й㷺Ӧ�á��ϳ�G��һ��·�����£�
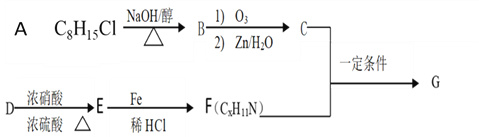
��![]()
��1molB��������Ӧ������2molC����C���ܷ���������Ӧ
��D���ڵ�ȡ������������Է�������Ϊ106
�ܺ˴Ź���������ʾF�����������ֻ�ѧ��������
��![]()
�ش��������⣺
��1��B�Ļ�ѧ����_________________��A����B�Ļ�ѧ����ʽ___________________________________
��2��A ����B , E ����F�ķ�Ӧ���ͷֱ���__________,___________
C+F ����G�Ļ�ѧ����ʽ________________________________________________________________
��3��E��ͬ���칹���У����б����Ͱ���������̼�����Ʒ�Ӧ����CO2�Ĺ���_______�֣����к˴Ź�������������壬�����֮��Ϊ1:2:2:2:2�Ľṹ��ʽΪ________________________������дһ�֣�
��4����֪![]() ������ϩΪԭ�ϣ������Լ���ѡ��д���ϳ���ˮ���Ͼ۱�ϩ���Ƶĺϳ�·��___________________________________________________________________________
������ϩΪԭ�ϣ������Լ���ѡ��д���ϳ���ˮ���Ͼ۱�ϩ���Ƶĺϳ�·��___________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��ԭ����������4�Ķ�����Ԫ�أ�Xm����Yn���������ӵĺ����Ų���ͬ������˵������ȷ����( )
A. X��ԭ�Ӱ뾶��YС B. X��Y�ĺ˵����֮��Ϊm��n
C. �縺��X>Y D. ��һ������X<Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����һ�����͵Ļ�ѧ��Դ���乹����ͼһ��ʾ��a��b�����缫���ɶ��̼�Ƴɣ�ͨ��������ɿ�϶���ݳ������ڵ缫����ŵ硣
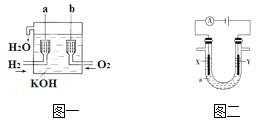
��1��a��________�����缫��Ӧʽ��_______________________��b��________�����缫��Ӧʽ��_______________________��
��2����ȼ�ϵ��������360 kg��ˮ�����·��ͨ����_____________mol�ĵ��ӡ�
��3������ͼ����ʾ��ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����
��X�缫�IJ�����________���缫��Ӧʽ��___________________��
��Y�缫�IJ�����______________���缫��Ӧʽ��_____________________��(˵�������ʷ����ĵ缫��Ӧ����д��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����������������������ǣ� ��
A.��100mL����ƿ����70mL0.1mol/L����
B.��������ƽ��ȡ25.20g�Ȼ���
C.��20mL����Ͳ��ȡ13.86mL NaOH��Һ
D.����������ȵ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com