
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题: 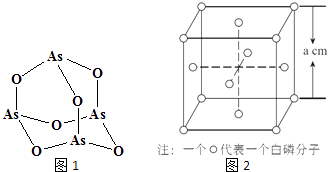
(1)As原子的核外电子排布式为 .
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是 .
(3)NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角(填“大”或“小”),原因是 .
(4)Na3AsO4中含有的化学键类型包括;AsO43﹣的空间构型为 , As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 .
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为gcm﹣3(用含NA、a的式子表示).
【答案】
(1)1s22s22p63s23p63d104s24p3
(2)P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大
(3)大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力
(4)离子键、共价键;正四面体;sp3
(5)离子
(6)16;![]()
【解析】解:(1)As原子核外电子数为33,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d104s24p3 , 所以答案是:1s22s22p63s23p63d104s24p3;(2)P的3p亚层是半充满状态,比较稳定,第一电离能高于同周期相邻元素的,第一电离能大于硫的,
所以答案是:P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大;(3)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角大,
所以答案是:大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力;(4)Na3AsO4属于离子化合物,含有离子键,酸根离子中含有共价键;AsO43﹣中As原子孤电子对数= ![]() =0、价层电子对数为4+0=4,空间构型为正四面体;As4O6的分子中As原子形成3个As﹣O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化,
=0、价层电子对数为4+0=4,空间构型为正四面体;As4O6的分子中As原子形成3个As﹣O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化,
所以答案是:离子键、共价键;正四面体;sp3;(5)化合物NH5中的所有原子最外层都满足稳定结构,则由铵根离子与氢负离子构成,属于离子晶体,所以答案是:离子;(6)根据均摊法可知,晶胞中P4分子数目为8× ![]() +6×
+6× ![]() =4,则晶胞中P原子数目为4×4=16,晶胞质量为16×
=4,则晶胞中P原子数目为4×4=16,晶胞质量为16× ![]() g,晶胞体积为(a cm)3 , 则晶胞密度为
g,晶胞体积为(a cm)3 , 则晶胞密度为 ![]() =
= ![]() g.cm﹣3 ,
g.cm﹣3 ,
所以答案是: ![]() .
.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于催化剂的说法正确的是( )
A.任何化学反应都需要催化剂B.化学反应中的催化剂一般并不唯一
C.催化剂对化学反应历程无影响D.催化剂的化学性质在反应前后会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸是生活中常见的有机物。下列说法不正确的是
A.两者互为同分异构体B.沸点都比CH4的沸点高
C.两者之间能发生反应D.两者均是某些调味品的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有广泛应用.
(1)已知:CO可将部分氮的氧化物还原为N2 . 反应Ⅰ:2CO(g)+2NO(g)N2(g)+2CO2(g)△H=﹣746kJmol﹣1
反应Ⅱ:4CO(g)+2NO2(g)N2(g)+4CO2(g)△H=﹣1200kJmol﹣1
写出CO将NO2还原为NO的热化学方程式 .
(2)在密闭容器中充入5mol CO和4mol NO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系. 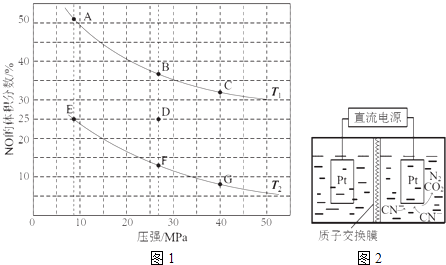
回答下列问题:
①温度:T1T2(填“<”或“>”).
②某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率v(CO)= .
③某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数K=(结果精确到0.01);若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点
(3)某温度时,亚硝酸银AgNO2的 Ksp=9.0×10﹣4、Ag2SO4的Ksp=4.0×10﹣5 , 当向含NO2﹣、SO42﹣混合溶液中加入AgNO3溶液至SO42﹣恰好完全沉淀(即SO42﹣浓度等于1.0×10﹣5 molL﹣1)时,c(NO2﹣)= .
(4)如图2,在酸性条件下,电解水中CN﹣可转化为CO2和N2 , 请写出阳极的电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解槽的叙述中不正确的是( )
A.与电源正极相连的是电解槽的阴极
B.与电源负极相连的电极发生还原反应
C.在电解槽的阳极发生氧化反应
D.电子从电源的负极沿导线流入阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述中正确的是( )
A.冰熔化时水分子中共价键发生断裂
B.原子晶体中只存在共价键,一定不含有离子键
C.金属晶体的熔沸点均很高
D.分子晶体中一定含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设想用如图所示装置生产硫酸,下列说法正确的是( ) 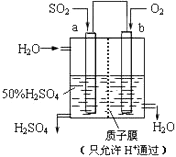
A.a为正极,b为负极
B.负极反应式为2H2O+SO2﹣2e﹣=SO42﹣+4H+
C.电子从b极向a极移动
D.生产过程中H+由b电极区通过质子膜向a电极区运动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com