
【题目】现代污水处理工艺中常利用聚合铁在水体中形成絮状物,以吸附![]() 等重金属离子,聚合铁简称PFS,化学式为
等重金属离子,聚合铁简称PFS,化学式为![]() 。下列说法错误的是
。下列说法错误的是
元素 | Mn | Fe | |
电离能/kJ·mol-1 |
| 717 | 762 |
| 1509 | 1561 | |
| 3248 | 2957 | |
A.PFS中铁元素显+3价
B.基态铁原子的价电子排布式为![]()
C.由![]() 溶液制备PFS需经过氧化、水解和聚合等过程
溶液制备PFS需经过氧化、水解和聚合等过程
D.由表可知再失去一个电子时,气态![]() 比气态
比气态![]() 难
难
【答案】D
【解析】
A.![]() 中OH-为-1价,
中OH-为-1价,![]() 为-2价,n小于5,且
为-2价,n小于5,且![]() 为正整数,根据化合物中各元素的化合价代数和为0,铁的化合价为正整数,所以n=2,铁元素的化合价为+3,因为亚铁离子在空气中不稳定,絮状物在空气之中能稳定存在进一步说明为铁为三价,故铁的化合价为+3价,A正确;
为正整数,根据化合物中各元素的化合价代数和为0,铁的化合价为正整数,所以n=2,铁元素的化合价为+3,因为亚铁离子在空气中不稳定,絮状物在空气之中能稳定存在进一步说明为铁为三价,故铁的化合价为+3价,A正确;
B.Fe的核外电子排布式为1s22s22p63s23p63d64s2,所以基态Fe原子的价电子排布式是3d64s2,B正确;
C.硫酸亚铁中铁元素的化合价是+2价,![]() 是个聚合物,其中铁元素的化合价是+3价,铁离子水解生成氢氧化铁,所以由
是个聚合物,其中铁元素的化合价是+3价,铁离子水解生成氢氧化铁,所以由![]() 溶液制PFS需经过氧化、水解和聚合的过程,C正确;
溶液制PFS需经过氧化、水解和聚合的过程,C正确;
D.电离能越大,其失电子越难,所以气态Fe2+再失去一个电子比气态Mn2+再失去一个电子容易,D错误;
故选D。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下图是探究温度对化学反应速率的影响的实验,其中三支试管中均为3 mL滴有FeCl3溶液的5% H2O2溶液(如下图所示)。
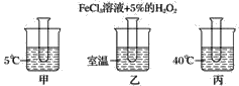
(1)三支试管内溶液产生氧气气泡速率由大到小为________。
(2)由上述实验可得出的结论为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g)
pC(g)
(I)若达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为___热反应,且m+n__p(填“>”、“=”或“<”)。
(2)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色___;而维持容器内压强不变,充入氖气时,混合物颜色___。(填“变深”、“变浅”或“不变”)。
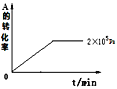
(II)若在容积可变的密闭容器中发生反应,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105Pa增加到5×105Pa时,平衡___移动(填:向左,向右,不)。
(2)维持压强为2×105Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入b molB,当重新达到平衡时,体系中气体总物质的量是___mol。
(3)当压强为1×106Pa时,此反应的平衡常数表达式:___。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105Pa时,A的转化率随时间变化如图,请在图中补充画出压强分别为5×105Pa和1×106Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒厂用含丰富淀粉的农产品做原料经过发酵酿酒,回答下列问题:
(1)写出主要反应的化学方程式:
第一步________________________________;
第二步________________________。
(2)某酒厂生产的啤酒长时间放置产生沉淀,造成产品滞销,经化验可知沉淀物为蛋白质。为解决这一问题,提出了两种方案。
甲:在酒中加入少量蛋白酶;
乙:在酒中加入少量氨基酸氧化酶。
试评价这两种方案:
①________方案合理,原因是_______________________;
②________方案不合理,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某课外活动小组在进行探究乙醇性质实验时遇到的问题,请你帮助解决。
(1)在做乙醇与钠反应的实验时,把一小块钠缓慢放入装有乙醇的试管内,与钠和水反应相比有所不同:①钠没有熔化成小球;②钠先沉在试管底;③反应后逐渐浮起。小组同学进行讨论,前两点现象解释达成共识。请说出你的看法:
①钠没有熔化成小球是因为_________________;
②钠先沉在试管底是因为__________________;
③第三点现象解释存在争议,活动小组的同学形成两种意见:a生成的氢气产生浮力所致;b生成的乙醇钠增大了溶液的密度所致。请你设计一个实验验证a和b说法的合理_________
(2)在做乙醇的催化氧化实验中,某同学有个意外发现:在酒精灯外焰上灼烧铜丝观察到铜丝表面变黑;当铜丝接近灯芯,变黑的铜丝又恢复原来的红色。请用化学方程式解释上述变化的过程_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正常人心脏在一次搏动中泵出血液约80 mL,正常人血压(可看作心脏压送血液的压强)平均值为1.6×104Pa,心跳每分钟约70次。设人类消耗体内的葡萄糖产生的热量最高可有80%(睡眠时)用来维持心脏的跳动,葡萄糖与氧气反应产生热量的化学方程式为:C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(g)(放出热量2804 kJ)
(1)心脏工作的平均功率约为______________;
(2)由于心脏跳动每天需消耗葡萄糖的质量是____________________________;
(3)维持生命每天需消耗氧气的体积是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
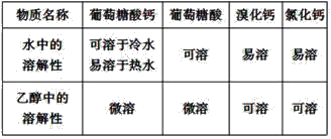
实验流程如下:
C6H12O6(aq)![]()
![]()
![]()
![]() 悬浊液
悬浊液![]()
![]()
![]() (C6H11O7)2Ca
(C6H11O7)2Ca
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是__。
A.
B.
C.
(2)制备葡萄糖酸钙的过程中,葡萄糖氧化也可用其它试剂,下列物质中最适合的是__。
A.新制氢氧化铜悬浊液
B.酸性高锰酸钾溶液
C.氧气/葡萄糖氧化酶
D.银氨溶液
(3)第②步充分反应后碳酸钙固体需有剩余,其目的是__。
(4)第②步实验中不用氯化钙替代碳酸钙的理由是__。
(5)第③步需趁热过滤的原因是__。
(6)第④步加入乙醇的作用是__。
(7)第⑥步中,下列洗涤剂最合适的是__。
A.冷水 B.热水
C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜(CuBr)微溶于水,不溶于乙醇,可用作有机合成中的催化剂。实验室中可利用无水硫酸铜、溴化钠为主要原料制备溴化亚铜,制备流程如下:

回答下列问题:
(1)过程①用到的玻璃仪器有烧杯、______,其中无水![]() 能否用蓝矾代替?做出判断,并说明理由:________。
能否用蓝矾代替?做出判断,并说明理由:________。
(2)制备CuBr的反应在装置乙中进行,向其中加入32gCuSO4和23g NaBr配制成的150mL水溶液,然后通入足量的SO2(部分夹持及加热装置已略去)。
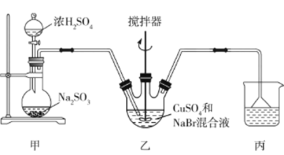
①装置甲中,不能采用浓度为98%的浓硫酸,一般采用浓度为70%左右的浓硫酸,其原因是________。
②写出装置乙中发生反应的离子方程式:_____,该反应需保持反应液在60℃,最佳加热方式为______,该装置中应用搅拌器搅拌的目的是______,Cu2+、Br-反应完毕的标志是______________。
③丙中倒扣的漏斗可防止液体倒吸,下列装置中不能防止液体倒吸的是________(填标号)。
a.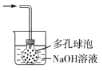 b.
b.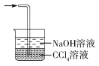 c.
c. d.
d.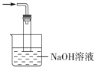
(3)洗涤CuBr沉淀时采用SO2的水溶液而不采用蒸馏水,其目的是_____________。
(4)最后经洗涤、干燥得到21.6g产品,则该实验的产率是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com