
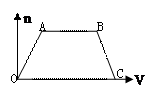
| A.-386kJ·mol-1 | B.+386kJ·mol-1 |
| C.-746kJ·mol-1 | D.+746kJ·mol-1 |
科目:高中化学 来源:不详 题型:单选题
| A.当10 NA个电子转移时,该反应放出1300kJ的能量 |
| B.当1 NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.当8 NA个碳氧共用电子对生成时,放出1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2H2(g)+ O 2(g) =" " 2H2O(1) H =" " —142.9kJ·molˉl H =" " —142.9kJ·molˉl |
B.2H2(g)+ O 2(g) =" " 2H2O(1) H =" " —571.6kJ·molˉl H =" " —571.6kJ·molˉl |
C.2H2+O2 = 2H2O H = —571.6lkJ·molˉl H = —571.6lkJ·molˉl |
D.H2(g)+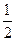 O 2(g) = H2O(1) O 2(g) = H2O(1) H = +285.8kJ·molˉl H = +285.8kJ·molˉl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
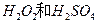 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: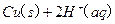 ====
====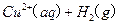
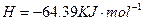
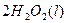 ====
====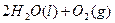
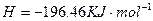
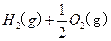 ="==="
="===" 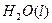
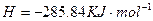
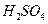 溶液中
溶液中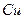 与
与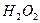 反应生成
反应生成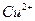 和
和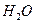 的热化方程式为 。
的热化方程式为 。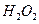 和3.0
和3.0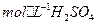 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 ( 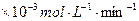 )[:.....] )[:.....] | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
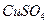 溶液中加入一定量的
溶液中加入一定量的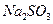 和
和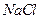 溶液,加热,生成
溶液,加热,生成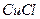 沉淀。制备
沉淀。制备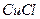 的离子方程式是 。
的离子方程式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.生成1molHCl气体时放出Q1热量 |
| D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.②③ | D.①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com