
【题目】为探究某物质X(仅含两种元素)的组成及和性质,设计并完成如下实验。(气体体积己转化为标准状况下的体积)
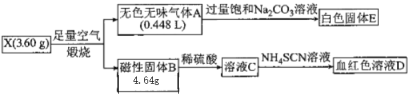
请回答下列问题:
(1)X的化学式__________,A的电子式_____________。
(2)无色气体A通入饱和碳酸钠溶液中的离子方程式__________。
(3)溶液C中滴加NH4SCN溶液可以检验某种阳离子的存在,请设计实验检验溶液C中另一种金属阳离子的实验方案_______。
【答案】Fe3C ![]() CO2+2Na++CO32-+H2O=2NaHCO3 取少量C溶液,滴加几滴酸性高锰酸钾溶液,若高锰酸钾溶液褪色,则溶液中存在Fe2+(其他答案合理均给分)
CO2+2Na++CO32-+H2O=2NaHCO3 取少量C溶液,滴加几滴酸性高锰酸钾溶液,若高锰酸钾溶液褪色,则溶液中存在Fe2+(其他答案合理均给分)
【解析】
X在空气中煅烧生成磁性固体四氧化三铁和无色无味气体,无色无味气体通入足量饱和碳酸钠溶液生成白色固体,生成了碳酸氢钠,说明无色气体为二氧化碳,从而得出由碳和铁元素组成,碳的物质的量等于二氧化碳的物质的量,二氧化碳物质的量为0.02 mol,碳的质量为0.24 g,铁的质量为3.36g,铁的物质的量0.06 mol,铁和碳的物质的量之比为3:1,即X化合物化学式为Fe3C。
⑴根据上面分析得出A为二氧化碳物质的量为0.02 mol,碳的质量为0.24 g,铁的质量为3.36g,铁的物质的量0.06 mol,铁和碳的物质的量之比为3:1,即X化合物化学式为Fe3C,A的电子式![]() ,故答案为:Fe3C;
,故答案为:Fe3C;![]() 。
。
⑵无色气体A通入饱和碳酸钠溶液中生成碳酸氢钠晶体,其离子方程式CO2+2Na++CO32-+H2O=2NaHCO3,故答案为:CO2+2Na++CO32-+H2O=2NaHCO3。
⑶实验检验溶液C中亚铁离子是否存在,取少量C溶液,滴加几滴酸性高锰酸钾溶液,若高锰酸钾溶液褪色,则溶液中存在Fe2+,或取少量C溶液,滴加加铁氰化钾溶液,若生成蓝色沉淀,则溶液中存在Fe2+,故答案为:取少量C溶液,滴加几滴酸性高锰酸钾溶液,若高锰酸钾溶液褪色,则溶液中存在Fe2+,或取少量C溶液,滴加加铁氰化钾溶液,若生成蓝色沉淀,则溶液中存在Fe2+。


科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
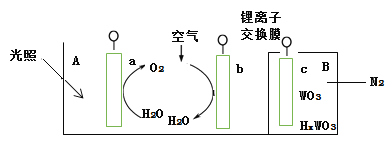
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如图:
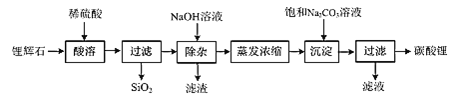
⑴写出“酸溶”时Li2O发生反应的离子方程式:______。
⑵“除杂”时所用NaOH溶液不能过量,原因是______。
⑶“除杂”时检验铁元素已完全除去的方法是______。
⑷写出“沉淀”时反应的化学方程式:______。
⑸检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
容器(温度) | t(min) c(molL-1) | 0 | 40 | 80 | 120 | 160 |
甲(400℃) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(400℃) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙(T℃) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.达到平衡状态时,2v正c(NO)=v逆c(N2)
B.容器内压强不再改变说明反应已达平衡
C.丙容器中从反应开始到建立平衡的平均反应速率v c(NO)=0.01125 mol·L-1·min-1
D.由表格数据可知:T>400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
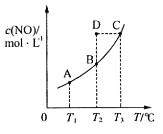
A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时![]()
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是

A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是
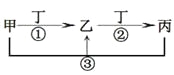
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com