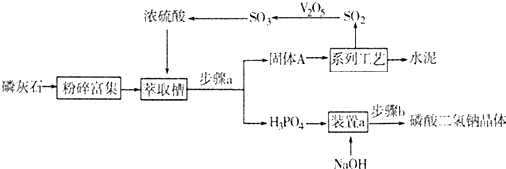
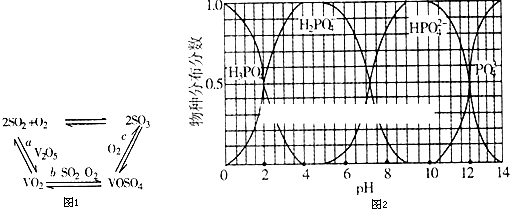
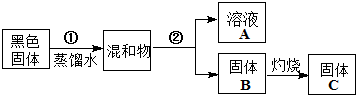
某实验小组对普通锌锰废干电池内的黑色固体进行探究,设计如下方案:
已知:Ⅰ、普通锌锰电池的黑色物质主要成分为MnO
2、NH
4Cl、ZnCl
2等物质.
Ⅱ、氢氧化锌为白色粉末,不溶于水,溶于酸、强碱溶液和氨水.
请回答以下问题:
(1)②操作的名称是
.
(2)某同学猜想溶液A的成分含有NH
4Cl和ZnCl
2,请你设计一个实验方案,验证其猜想正确,要求在答题卡上按下表格式写出实验操作、预期现象和结论.限选试剂:蒸馏水、2moL?L
-1 HCl、2moL?L
-1 HNO
3、2moL?L
-1NH
3?H
2O、6moL?L
-1NaOH、0.1mol?L
-1 KSCN、0.1mol?L
-1BaCl
2、0.1mol?L
-1AgNO
3、紫色石蕊试液、红色石蕊试纸
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管, | 有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管, |
|
|
| 步骤3:往c试管, | 先产生 ,
后 | 说明溶液A含有Zn2+ |
(3)取少量固体C放入试管,滴加入双氧水,观察到有气体产生,写出该反应的化学方程式:
.
(4)为测定废干电池中二氧化锰的质量分数,进行下面实验:准确称取a g废干电池固体,溶于稀硫酸,加入碘化钾溶液,充分反应后,用bmol/L硫代硫酸钠标准溶液滴定,用淀粉作指示剂,滴定至终点,重复实验,平均消耗硫代硫酸钠标准溶液的体积为vmL,则废电池中二氧化锰的质量分数的计算表达式为:
.(滴定有关反应:MnO
2+2I
-+4H
+=Mn
2++I
2+2H
2O;I
2+2S
2O
32-=2I
-+S
4O
62-)