
【题目】将由Al、CuO、Fe2O3组成的混合物10.0 g放入250 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol·L-1的NaOH溶液时,得到的沉淀最多。该盐酸的浓度为( )
A.0.5 mol·L-1B.3.0 mol·L-1C.2.0 mol·L-1D.1.0 mol·L-1
【答案】C
【解析】
Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,根据氯离子守恒有n(HCl)=n(NaCl),根据钠离子守恒有n(NaCl)=n(NaOH),再根据c=![]() 计算盐酸的浓度。
计算盐酸的浓度。
Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最多,溶液中金属离子完全沉淀,此时溶液中溶质为NaCl,根据钠离子守恒有n(NaCl)=n(NaOH)=0.25L×2.0mol/L=0.5mol,根据氯离子守恒有n(HCl)=n(NaCl)=0.5mol,故该盐酸的物质的量浓度=![]() =2.0mol/L,故C正确;
=2.0mol/L,故C正确;


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】H是一种重要的化工原料,它可由石油和煤焦油通过下列路线合成:
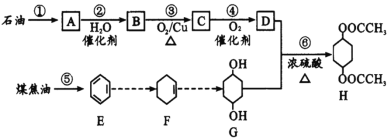
(1)A的名称是____;过程①是____变化(填“物理”或“化学”,下同),过程⑤是_______变化。
(2)反应③的化学方程式为_______;反应⑥的类型为_________。
(3)鉴别E与F的方法是_________________。
(4)H中六元环上的氢原子被两个氯原子取代后的有机物有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图所示装置进行探究实验制取乙烯并验证乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。

(1)写出该实验中制取乙烯的化学方程式:_____________________。
(2)验证乙烯具有不饱和性的化学方程式是:_________________________
(3)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是________(填字母序号)。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.乙醇被氧化生成的气体产物,也会使溴水褪色
(4)乙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,则A中的试剂应为________,其作用是________,B中的试剂为________。
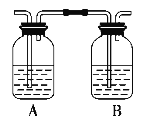
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有( )个
①可以用Cu(OH)2悬浊液用一种试剂鉴别甲酸、乙酸、乙醛、乙醇。
②可用酸性K2Cr2O7溶液检验是否酒后驾车,该应用利用了乙醇的还原性和低沸点的性质。
③向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制可得银镜。
④向足量的浓苯酚溶液中滴入少量溴水,可观察到有白色沉淀生成,该沉淀为2,4,6-三溴苯酚。
⑤该分子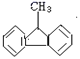 中的碳原子可能都在同一平面。
中的碳原子可能都在同一平面。
⑥做过银镜反应实验后的试管,用氨水洗涤。
A.5B.4C.3D.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.钠与水反应:Na + 2H2O = Na++ 2OH-+ H2↑
B.硅酸钠溶液与醋酸溶液混合:SiO32- + 2H+= H2SiO3↓
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++ 2SO42-+ 2Ba2++ 4OH-= 2BaSO4↓ + Al(OH)3↓ + NH3·H2O
D.浓硝酸中加入过量铁粉并加热:Fe + 3NO3-+ 6H+![]() Fe3++ 3NO2↑ + 3H2O
Fe3++ 3NO2↑ + 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒素是辣椒的活性成分,可在口腔中产生灼烧感,能够起到降血压和胆固醇的功效,进而在很大程度上预防心脏病,也能缓解肌肉关节疼痛。辣椒素酯类化合物的通式可以表示为![]() (R为烃基),其中一种辣椒素酯类化合物J的合成路线如图所示:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如图所示:
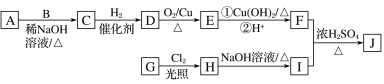
已知:①A、B、E互为同系物,其中A的分子式为C5H10O,B的相对分子质量为44,A和B的核磁共振氢谱显示都有两组峰。
②J的分子式为C15H22O4。
③R1CHO+R2CH2CHO![]()
![]() 。
。
回答下列问题:
(1)G中所含官能团的名称为__________。
(2)由A和B生成C的化学方程式为__________。
(3)由C生成D的反应类型为________,D的化学名称为_________。
(4)由H生成I的化学方程式为________。
(5)在G的同分异构体中,苯环上的一氯代物只有一种的共有_____种(不含立体异构),其中核磁共振氢谱显示两组峰的是_______(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是( )
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B.为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C.①、③混合后发生反应:![]()
D.向①中加入②,H+与OH-反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3:物质结构与性质】A、B、C、D、E五种元素的原子序数依次增大,其中非金属元素A的基态原子中成对电子数是未成时电子数的两倍,C元素在地壳中含量最高,D的单质是短周期中熔点最低的金属,E的合金是我国使用最早的合金。
(1)E元素的基态原子电子排布式为__________________。
(2)A的某种氢化物A2H2分子中含有___个σ键和____个π键。
(3)A 的含氧酸根离子AO3n-的空间构型是___________。
(4)B的最简单的氢化物的沸点比A 的最简单的氢化物的沸点高得多,其原因是_____。
(5)E的最高价氧化物对应的水化物溶解于氨水中生成的复杂化合物的化学式是______。
(6)下图是D单质的晶体堆积方式,这种堆积方式的晶胞中原子的配位数为____,若该原子的半径为rpm ,此晶体的密度ρ=______g/cm3(用含r的代数式表示,阿伏伽德罗常数用NA表示)。
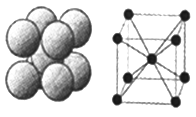
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量 Al4C3、Al2O3 、C 等杂质。某化学实验小组设计了如下实验, 分别测定氮化铝(AlN)样品中 AlN 和 Al4C3 的质量分数(忽略NH3在强碱溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸发生复分解反应,写出该反应的化学方程式 ___________。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN和NaOH溶液反应的化学方程式_______。实验装置如下图所示:
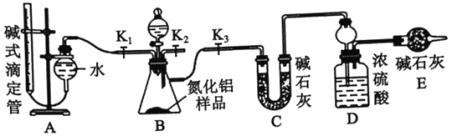
(2)实验过程:
①根据题干信息:连接实验装置,检查装置气密性。称得D装置的质量为y g,滴定管的读数为amL。该步骤中,检查装置A气密性的操作为___________。
②称取x g AlN 样品置于锥形瓶中; 塞好胶塞, 关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入足量的____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3, 通过分液漏斗加入过量_________(填化学式),与锥形瓶内溶质充分反应。
④_____(填入该步应进行的操作)。
⑤实验中记录滴定管的读数为b mL,称得D装置的质量为z g。
(3)数据
①AlN 的质量分数为____________。
②若读取滴定管中气体的体积时,先冷却到室温,再__________,然后平视凹液面读数。液面左高右低,则所测气体的体积___________(填“偏大”“偏小”或“无影响”)。
③Al4C3的质量分数为 ____________(该实验条件下气体摩尔体积为Vm molL-1) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com