
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是( )
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B.为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C.①、③混合后发生反应:![]()
D.向①中加入②,H+与OH-反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
【答案】A
【解析】
A. 水溶液能完全电离的电解质是强电解质,水溶液中部分电离属于弱电解质;
B. Mg(OH)2沉淀电离出来的OH-与NH4Cl电离出来的NH4+结合生成弱电解质,使c(OH-)减小,即促进Mg(OH)2的溶解;
C. NH4+能结合Mg(OH)2电离出的OH-,生成弱电解质;
D. 根据Mg(OH)2沉淀的溶解平衡移动分析。
A. 向Mg(OH)2中滴入几滴酚酞试液后,溶液显红色,只能说明Mg(OH)2能电离,使溶液呈碱性,但不能判断是部分电离还是完全电离,A项错误,符合题意;
B. Mg(OH)2沉淀电离出来的OH-与NH4Cl电离出来的NH4+结合生成NH3H2O,使Mg(OH)2悬浊液溶解的更快,可加入过量的NH4Cl浓溶液,B项正确,不符合题意;
C. NH4+结合Mg(OH)2沉淀电离出来的OH-生成NH3H2O,所以①、③混合后发生反应:![]() ,C项正确,不符合题意;
,C项正确,不符合题意;
D. Mg(OH)2的悬浊液中存在沉淀的溶解平衡,因此向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动,D项正确,不符合题意;
答案选A。


科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、OH-、Na+、K+、NO![]() ,加入铝粉后,只产生H2,为探究该溶液中存在的离子,某学习小组进行了如下实验。
,加入铝粉后,只产生H2,为探究该溶液中存在的离子,某学习小组进行了如下实验。
(1)甲同学分析“若H+大量存在,则NO![]() 就不能大量存在”,设计实验证实如下:
就不能大量存在”,设计实验证实如下:
装置 | 现象 |
| Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方出现浅棕色气体 Ⅲ.试管变热,溶液沸腾 |
①现象Ⅲ产生的原因___。
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验 | 内容 | 现象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 试纸未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
实验1、2说明反应生成了NO。
请用化学方程式解释气体变为浅棕色的原因___。
(2)乙同学分析“若OH-大量存在,NO![]() 也可能不大量存在”,重新设计实验证实如下:
也可能不大量存在”,重新设计实验证实如下:
装置 | 现象 |
| Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
为确认:"刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
产生该刺激性气味气体的离子方程式是___。
(3)甲、乙两位同学设计的实验初始时均未见明显现象的原因是___。
(4)根据以上实验分析,该溶液中一定大量存在的离子是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:

下列说法正确的是
A.m>nB.Q<0
C.温度不变,压强增大,Y的质量分数减少D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将由Al、CuO、Fe2O3组成的混合物10.0 g放入250 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol·L-1的NaOH溶液时,得到的沉淀最多。该盐酸的浓度为( )
A.0.5 mol·L-1B.3.0 mol·L-1C.2.0 mol·L-1D.1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的结构简式。
(1)2,3二甲基戊烷_________;
(2)2,3二甲基1丁烯____________;
用系统命名法命名下列有机物。
(3)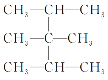 :___________
:___________
(4)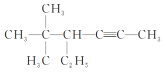 :___________
:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100℃ Cu(NO3)2 的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4 和Cu(OH)2 反应制备 Cu2O 的热化学方程式为 ________________________。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
(1)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是(_______)
CH3OH(g)已达平衡状态的是(_______)
A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2 和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2 的转化率将 ______(填“增大”、 “减小”或“不变”);
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
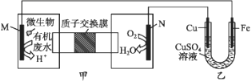
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-![]() 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+
C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
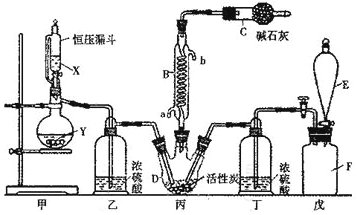
(1)仪器E的名称是_______,由B的使用可知SO2与氯气之间的反应居于______(填“放”或“吸”)热反应,B处反应管冷却水应从___________(填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是__________。
(2)试剂X、Y的组合最好是_________。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为__________%(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com