
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
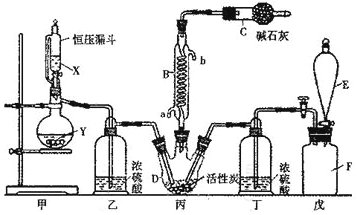
(1)仪器E的名称是_______,由B的使用可知SO2与氯气之间的反应居于______(填“放”或“吸”)热反应,B处反应管冷却水应从___________(填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是__________。
(2)试剂X、Y的组合最好是_________。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为__________%(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是______。
【答案】分液漏斗 放 a 该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成 c 饱和食盐水 SO2+ Cl2+2H2O=H2SO4+2HCl 86.9 因为SO2Cl2自身分解生成Cl2, Cl2溶于使液体呈黄色
【解析】
(1)根据装置图可知,E为分液漏斗,因蛇形冷凝管的作用是冷凝回流而反应又没有加热,故SO2与氯气间的反应为放热反应;根据下进上出,的原则,B处反应管冷却水应从a接口通入;由于该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成;故答案为分液漏斗;放;a;该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成;
(2)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2,所以用c.60% H2SO4+K2SO3来制备SO2,故选c;
(3)因氯水不溶于饱和食盐水,故E中的试剂是饱和食盐水,氯气在水存在的条件下可将SO2氧化成硫酸,自身被还原为HCl,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,故答案为饱和食盐水;SO2+Cl2+2H2O=H2SO4+2HCl;
(4)设所得馏分中二氯化砜的质量百分含量为x,则:
SO2Cl2~H2SO4~BaSO4
135 233
1.00g×x 1.5g
所以135:233=1.00g×x:1.5g
解得x=86.9%
故答案为86.9;
(5)SO2Cl2久置后分解会生成氯气,可能是溶解氯气所致,故答案为二氯化砜久置后分解生成的氯气,溶解在二氯化砜中,使液体呈黄色。


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是( )
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B.为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C.①、③混合后发生反应:![]()
D.向①中加入②,H+与OH-反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H++ SO2↑+S↓+2Na+ + H2O
B.氢氧化亚铁暴露于空气中会变色:4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3
C.将少量的 SO2气体通入NaClO溶液中:SO2 +H2O+ 2ClO- = SO![]() + 2HC1O
+ 2HC1O
D.草酸使酸性KMnO4溶液褪色: 2MnO![]() + 16H++ 5 C2O
+ 16H++ 5 C2O![]() = 2Mn2+ + 10CO2↑+ 8H2O
= 2Mn2+ + 10CO2↑+ 8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量 Al4C3、Al2O3 、C 等杂质。某化学实验小组设计了如下实验, 分别测定氮化铝(AlN)样品中 AlN 和 Al4C3 的质量分数(忽略NH3在强碱溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸发生复分解反应,写出该反应的化学方程式 ___________。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN和NaOH溶液反应的化学方程式_______。实验装置如下图所示:
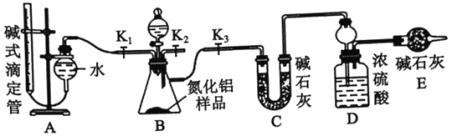
(2)实验过程:
①根据题干信息:连接实验装置,检查装置气密性。称得D装置的质量为y g,滴定管的读数为amL。该步骤中,检查装置A气密性的操作为___________。
②称取x g AlN 样品置于锥形瓶中; 塞好胶塞, 关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入足量的____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3, 通过分液漏斗加入过量_________(填化学式),与锥形瓶内溶质充分反应。
④_____(填入该步应进行的操作)。
⑤实验中记录滴定管的读数为b mL,称得D装置的质量为z g。
(3)数据
①AlN 的质量分数为____________。
②若读取滴定管中气体的体积时,先冷却到室温,再__________,然后平视凹液面读数。液面左高右低,则所测气体的体积___________(填“偏大”“偏小”或“无影响”)。
③Al4C3的质量分数为 ____________(该实验条件下气体摩尔体积为Vm molL-1) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g)。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
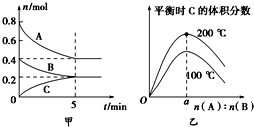
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04molL-1min-1
B.200℃时,该反应的平衡常数为25L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 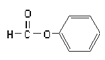 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯基铁[ Fe(C5H5)2]是一种有机过渡金属化合物,常温下为橙黄色粉末,难溶于水,易溶于有机溶剂,温度超过100 °C能够升华,实验室制备环戊二烯基铁的装置和步骤如下:
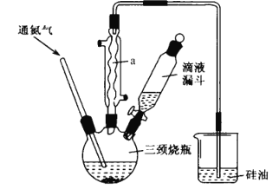
实验步骤:
步骤1:在三颈烧瓶中加入10mL乙二醇二甲醚(作溶剂)和4. 5 g研细的 KOH 粉末,通入氮气并开启磁力搅拌器 ,然后加入1. 5mL环戊二烯(过量);
步骤2:将1.5g FeCl24H2O溶于5 mL二甲基亚砜中 ,并转入滴液漏斗中,将步骤1中的混合物猛烈搅拌10 min,打开滴液漏斗将氯化亚铁的二甲基亚砜溶液在45 min钟左右滴完;
步骤3:关闭滴液漏斗,在氮气保护下继续搅拌30 min;
步骤4:将反应后的混合液倒入100 m L烧杯内,加入少量盐酸除去剩余的KOH,再加入20mL 水,继续搅拌悬浊液15min,抽滤产物,并用水洗涤产物3~4次,最后将产物铺在面皿上,置于真空干燥器内干燥。回答下列问题:
(1)仪器a的作用是___________________。
(2)制备过程中若不通入氮气,会降低环戊二烯基铁的产率,试分析其中的原因: __________。
(3)硅油的主要作用是______。
(4)步骤4中分离环戊二烯基铁也可采用如下方法,请将分离步骤补充完整:向反应后的混合液加入10 mL乙醚(ρ= 0.71g cm-3 ) 充分搅拌,然后转入_____(填仪器名称)中,依次用盐酸、水各洗涤两次,待液体分层后_____________(填完整操作过程),将含有二环戊二烯基合铁的溶液在通风橱中蒸发得到二环戊二烯基合铁粗产品。
(5)可采用如图所示的简易装置分离提纯环戊二烯基铁。将颗粒状环戊二烯基铁放入蒸发皿中并小火加热,环戊二烯基铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______________,装置棉花的作用是___________。
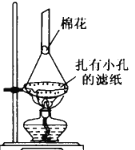
(6)若最终制得环戊二烯基铁质量为 0.16g,则产率为_____%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.钠与水反应:Na+H2O==Na++OH-+H2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=![]() +4
+4![]() +2H2O
+2H2O
C.FeCl3溶液净水原理:Fe3++3H2O=Fe(OH)3↓+3H+
D.用饱和Na2CO3溶液处理重晶石:BaSO4+![]() -==BaCO3+
-==BaCO3+![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com