
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100℃ Cu(NO3)2 的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4 和Cu(OH)2 反应制备 Cu2O 的热化学方程式为 ________________________。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
(1)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是(_______)
CH3OH(g)已达平衡状态的是(_______)
A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2 和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2 的转化率将 ______(填“增大”、 “减小”或“不变”);
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________。

【答案】2 Cu-2e-+2OH-=Cu2O+H2O 4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +4b+c-a kJ/mol或者【△H=(4b+c-a kJ/mol)】 CD 0.12 mol/(L·min) 9.375 增大 相对于 N 点而言,采用 M 点,温度在 500~600 K 之间,温度较高,反应速率较快,CO 的平衡转化率也较高,压强为常压,对设备要求不高
【解析】
(1)工业上用铜作阳极,钛片为阴极,电解法电解一定浓度的NaOH 溶液可制备氧化亚铜,则阳极的电极反应式为Cu-2e-+2OH-=Cu2O+H2O:答案:Cu-2e-+2OH-=Cu2O+H2O。
(2)①将题中所给反应方程式依次编号:(1)N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol;(2)Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol;(3)4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol;由盖斯定律4![]() (2)+(3)-(1)有:4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +(4b+c-a) kJ/mol 答案:4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +4b+c-a kJ/mol。
(2)+(3)-(1)有:4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +(4b+c-a) kJ/mol 答案:4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +4b+c-a kJ/mol。
Ⅱ.(1) A.由CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,知当反应的热效应△H = -90.8 kJ/mol 时,不能确定反应否达到平衡状态,故A错误;B.混合气体总质量不变,容器容积恒定,容器内混合气体的密度始终保持不变,故B错误;C.在绝热恒容的容器中,随反应进行温度发生变化,平衡常数也随之发生变化,当反应的平衡常数不再变化时说明反应到达平衡,故C正确的;D.混合气体总质量不变,随反应进行混合气体总物质的量增大,则气体的平均摩尔质量进行,当气体的平均摩尔质量不再变化时,说明反应到达平衡,故D正确;答案:CD正确的;
CH3OH(g) △H = -90.8 kJ/mol,知当反应的热效应△H = -90.8 kJ/mol 时,不能确定反应否达到平衡状态,故A错误;B.混合气体总质量不变,容器容积恒定,容器内混合气体的密度始终保持不变,故B错误;C.在绝热恒容的容器中,随反应进行温度发生变化,平衡常数也随之发生变化,当反应的平衡常数不再变化时说明反应到达平衡,故C正确的;D.混合气体总质量不变,随反应进行混合气体总物质的量增大,则气体的平均摩尔质量进行,当气体的平均摩尔质量不再变化时,说明反应到达平衡,故D正确;答案:CD正确的;
(2)① H2和CO总共为3mol,且起始n(H2)/n(CO)= 2,可以知道H2为2mol、CO为1mol, 5min 达到平衡时CO的转化率为0.6,则:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol)12 0
变化(mol)0.6 1.2 0.6
平衡(mol)0.4 0.8 0.6
容器的容积为2L,则v (H2)= (1.2mol![]() )/5min=0.12 mol/(L·min);该温度下平衡常数K= c(CH3OH)/c(CO)
)/5min=0.12 mol/(L·min);该温度下平衡常数K= c(CH3OH)/c(CO)![]() c(H2)=(0.6
c(H2)=(0.6![]() /( 0.4
/( 0.4![]() 0.8
0.8![]() 2=9.375。此时再向容器中加入CO(g) 和CH3OH(g) 各0.4mol,此时浓度商 Qc=[(0.6+0.4)
2=9.375。此时再向容器中加入CO(g) 和CH3OH(g) 各0.4mol,此时浓度商 Qc=[(0.6+0.4)![]() /[(0.4+0.4)
/[(0.4+0.4)![]() 2]
2]![]() 0.8
0.8![]() 2=7.813<9.375,所以反应向正反应进行,达新平衡时H2的转化率将增大。因此答案是: 0.12 mol/(L·min) ; 9.375;增大。
2=7.813<9.375,所以反应向正反应进行,达新平衡时H2的转化率将增大。因此答案是: 0.12 mol/(L·min) ; 9.375;增大。
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件是:相对于N点而言,采用M点,温度在500~600 K之间,温度较高,反应速率较快, CO的平衡转化率也较高,压强为常压,对设备要求不高。答案:相对于 N 点而言,采用 M 点,温度在 500~600 K 之间,温度较高,反应速率较快,CO 的平衡转化率也较高,压强为常压,对设备要求不高。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成:

回答下列问题:
(1)11.2 L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45gH2O。A的分子式是___________。
(2)D的名称(系统命名)为____________________;
(3)在催化剂存在下1mol F与2 mol H2反应,生成3-苯基-1-丙醇,F的结构简式是_______________;
(4)反应①的反应类型是___________________;
(5)反应②的化学方程式为___________________;
(6)与G具有相同的官能团的芳香类同分异构体有________种(不含G),其中HNMR中有五组峰,峰面积比为1∶1∶2∶2∶2的异构体的结构简式:___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种无毒、用途广泛的化工原料,被誉为当今有机合成的“新基石”。
(1)浙江大学用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC的研究开发。已知:
(ⅰ)CO的标准燃烧热:283.0 kJmol﹣1,
(ⅱ)1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
(ⅲ)2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) △H=﹣15.5kJmol﹣1
CH3OCOOCH3(g)+H2O(g) △H=﹣15.5kJmol﹣1
则2CH3OH(g)+CO(g)+1/2O2(g) ![]() CH3OCOOCH3(g)+ H2O(l) △H=______.
CH3OCOOCH3(g)+ H2O(l) △H=______.
该反应在常压和70~120℃条件下就能自发反应的原因是___________________.
(2)甲醇和CO2可直接合成DMC:
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g),但由于甲醇转化率通常不会超过1%,因此制约该反应走向工业化生产.
CH3OCOOCH3(g)+H2O(g),但由于甲醇转化率通常不会超过1%,因此制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________________________.
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是__________(选填编号)。
A.v正(CH3OH)=2v逆(CO2) B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变 D.容器内压强不变

③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10﹣5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。(计算公式:TON=转化的甲醇的物质的量/催化剂的物质的量)在该温度下,最佳反应时间是_____;4~10h内DMC的平均反应速率是_______.
④如果在其它条件不变的情况下,研究反应温度对甲醇转化数(TON)的影响,请在图的坐标系中画出从投入反应物开始,随着反应温度不断升高(不考虑温度对催化剂活性的影响),TON变化的曲线示意图(假设起始温度为T0℃)__________________.

⑤假设在密闭容器中发生上述反应,达到平衡时下列措施能提高TON值的是______.
A.往反应体系中添加催化剂 B.往反应体系中添加吸水剂
C.从反应体系中分离出CO2 D.扩大容器的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某些化学键的键能数据如下:

(1)通过比较C—C 和 C=C 的键能大小,简要说明为什么烯烃易发生加成反应而烷烃不能?______ 。
(2)利用键能数据可判断反应 2H2 + O2 → 2 H2O 为 放热反应, 计算每生成 1 mol H2O 所放出的热量为_____________ kJ。
(3)若某有机物的结构简式如下: ![]() ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:________________
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:________________
(4)将硫酸铜白色固体溶于水得到蓝色的溶液,原因是生成了一种配合离子,其结构简式为: ___________(标明配位键),向该溶液中加入过量稀氨水得深蓝色溶液,其离子方程式为 _________ 。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)制备精细化工产品PbSO4·3PbO·H2O(三盐)的主要流程如下:

已知:常温下,Ksp(PbSO4)=2.0×10-8 Ksp(PbCO3)=1.0×10-13 ,请回答以下问题:
(1)铅蓄电池工作原理是PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,在放电过程中负极的质量__________;电解质溶液的pH___________(用“变大”、“不变”或“变小”填写)。该铅蓄电池放电过程中的正极反应式为__________________________________________。
2PbSO4+2H2O,在放电过程中负极的质量__________;电解质溶液的pH___________(用“变大”、“不变”或“变小”填写)。该铅蓄电池放电过程中的正极反应式为__________________________________________。
(2)步骤③的目的是使铅泥中的Pb溶解,其对应的离子方程式为________________ 。滤液2中的溶质主要是_____________(填化学式),过滤操作中使用到的玻璃仪器有_____。
(3)步骤⑥合成三盐的化学方程式为________________________。
(4)步骤⑦洗涤产品的方法是________________________________。
(5)在“转化”过程中,若PbSO4和PbCO3在悬浊液中共存,则c(SO42-):c(CO32-)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A(C8H8)为主要原料,采用以下路线合成某药物G:

请回答以下问题:
(1)A的化学名称是____________ ;D含有的官能团名称是 __________________。
(2)反应③和⑥的反应类型分别是_________________ 、______________________。
(3)③的反应方程式为___________________________________________________。
(4)E的分子式为 _________________________________。
(5)写出两种符合下列条件的F的同分异构体的结构简式_______________、___________。
①遇FeCl3溶液发生显色反应;②既能水解,也能发生银镜反应;③苯环上的一氯代物只有一种;④核磁共振氢谱显示有6种不同化学环境的氢,峰面积之比为1:1:2:2:2:6
(6)参考题中信息和所学知识,设计由丙酮(CH3COCH3)和乙醇为主要有机原料合成 ![]() 的路线流程图_______________。
的路线流程图_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RO4n-离子在一定条件下可以把CI-离子氧化为ClO-,若RO4n-离子变为RO32-离子,又知反应中RO4n-与Cl-的物质的量之比为1:1,则RO4n-中R元素的化合价为 ( )
A. +4 B. +5 C. +6 D. +7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
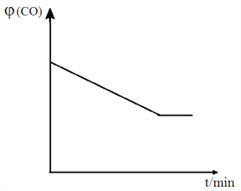
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com