
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)制备精细化工产品PbSO4·3PbO·H2O(三盐)的主要流程如下:

已知:常温下,Ksp(PbSO4)=2.0×10-8 Ksp(PbCO3)=1.0×10-13 ,请回答以下问题:
(1)铅蓄电池工作原理是PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,在放电过程中负极的质量__________;电解质溶液的pH___________(用“变大”、“不变”或“变小”填写)。该铅蓄电池放电过程中的正极反应式为__________________________________________。
2PbSO4+2H2O,在放电过程中负极的质量__________;电解质溶液的pH___________(用“变大”、“不变”或“变小”填写)。该铅蓄电池放电过程中的正极反应式为__________________________________________。
(2)步骤③的目的是使铅泥中的Pb溶解,其对应的离子方程式为________________ 。滤液2中的溶质主要是_____________(填化学式),过滤操作中使用到的玻璃仪器有_____。
(3)步骤⑥合成三盐的化学方程式为________________________。
(4)步骤⑦洗涤产品的方法是________________________________。
(5)在“转化”过程中,若PbSO4和PbCO3在悬浊液中共存,则c(SO42-):c(CO32-)=____________。
【答案】变大 变大 PbO2+SO42-+4H++2e-=PbSO4+2H2O 3Pb+8H++2NO3-=3Pb2++2NO+4H2O HNO3 玻璃棒、烧杯、漏斗 4PbSO4+6NaOH=3Na2SO4+PbSO43PbOH2O+2H2O 将产品放入过滤器中,加入蒸馏水没过产品,让谁自然流下,重复2至3次 2.0×105
【解析】
题时抓住流程中物质转化原理及铅蓄电池工作原理,分析元素化合价变化,弄清滤液和滤渣的主要成分,根据物质性质推断相关的化学反应;区别放电和充电,根据电极反应类型书写电极反应式。
(1)铅蓄电池工作原理是PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,在放电过程中负极电极反应式:Pb+ H2SO4-2e-=PbSO42-+4H+,所以负极的质量变大;放电时,正极的电极反应式为PbO2+2e-+ SO42-+4H+
2PbSO4+2H2O,在放电过程中负极电极反应式:Pb+ H2SO4-2e-=PbSO42-+4H+,所以负极的质量变大;放电时,正极的电极反应式为PbO2+2e-+ SO42-+4H+![]() PbSO4+2H2O,电解质溶液的H+浓度减小,所以pH变大。答案:变大;变大 ; PbO2+SO42-+4H++2e-=PbSO4+2H2O。
PbSO4+2H2O,电解质溶液的H+浓度减小,所以pH变大。答案:变大;变大 ; PbO2+SO42-+4H++2e-=PbSO4+2H2O。
(2)步骤③的目的是使铅泥中的Pb溶解,其对应的离子方程式为3Pb+8H++2NO3-=3Pb2++2NO+4H2O 。沉铅涉及的反应为Pb(NO3)2+H2SO4![]() PbSO4↓+2HNO3。所以滤液Ⅱ中的溶质主要是HNO3,过滤操作中使用到的玻璃仪器有玻璃棒、烧杯、漏斗。答案: 3Pb+8H++2NO3-=3Pb2++2NO+4H2O ; HNO3 ;玻璃棒、烧杯、漏斗。
PbSO4↓+2HNO3。所以滤液Ⅱ中的溶质主要是HNO3,过滤操作中使用到的玻璃仪器有玻璃棒、烧杯、漏斗。答案: 3Pb+8H++2NO3-=3Pb2++2NO+4H2O ; HNO3 ;玻璃棒、烧杯、漏斗。
(3) 加入NaOH溶液,合成三盐的化学方程式为4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O↓+3Na2SO4+2H2O。答案:4PbSO4+6NaOH=3Na2SO4+PbSO43PbOH2O+2H2O
3PbO·PbSO4·H2O↓+3Na2SO4+2H2O。答案:4PbSO4+6NaOH=3Na2SO4+PbSO43PbOH2O+2H2O
(4) 向装产品的过滤器中加入蒸馏水没过产品,让水自然流下,重复2至3次即可;答案:将产品放入过滤器中,加入蒸馏水没过产品,让水自然流下,重复2至3次 。
(5) PbSO4(s)+ CO32-(aq)![]() PbCO3(s)+ SO42-(aq);K=c(SO42-)/c(CO32-)= Ksp(PbSO4)/ Ksp(PbCO3)=2.0×10-8/1.0×10-13 ==2.0×105。所以在转化过程中,PbSO4和PbCO3在悬浊液中共存时,则c(SO42-):c(CO32-)=2.0×105。答案:2.0×105。
PbCO3(s)+ SO42-(aq);K=c(SO42-)/c(CO32-)= Ksp(PbSO4)/ Ksp(PbCO3)=2.0×10-8/1.0×10-13 ==2.0×105。所以在转化过程中,PbSO4和PbCO3在悬浊液中共存时,则c(SO42-):c(CO32-)=2.0×105。答案:2.0×105。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合忽略体积变化;计算结果保留到小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入_________mL。
(2)若用pH=2的盐酸,应加入_________mL。
(3)若用水稀释,则加入水的体积为____________________ mL。
(4)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=11的NaOH溶液中由水电离出的H+浓度为c2,则c1/c2=_________。
(5)常温下,pH=11的NaOH溶液aL与pH=5的H2SO4溶液bL混合,若所得混合溶液呈中性,则a∶b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5 种物质:①空气 ②CO2 ③乙醇 ④CaCO3 ⑤Al(OH)3;按要求填空(填代号):
(1)属于混合物的是_______;
(2)属于氧化物的是_______;
(3)属于碱的是_______;
(4)属于有机物的是_______;
(5)属于盐的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的溶液中,下列各组离子中能大量共存的是
A. K+、H+、SO42—、OH— B. Ba2+、K+、SO42—、NO3—
C. Na +、H+、Cl—、CO32- D. Na +、Cu2+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素在生活、生产和科技等方面有广泛的用途。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________(填序号)。
A.PFS中铁显+2价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
Mn | Fe | ||
电离能 | I1 | 717 | 759 |
(kJ·mol-1) | I2 | 1 509 | 1 561 |
I3 | 3 248 | 2 957 |
(2)PFS中SO42-采取__________杂化,空间构型是_________。
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬与甲基丙烯酸根的配合物为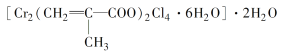
①该化合物中铬的化合价为___________。
②该化合物中一个Cr的配位数为________。
③甲基丙烯酸分子中C原子的杂化方式有___________________________________。
(4)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100℃ Cu(NO3)2 的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4 和Cu(OH)2 反应制备 Cu2O 的热化学方程式为 ________________________。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
(1)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是(_______)
CH3OH(g)已达平衡状态的是(_______)
A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2 和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2 的转化率将 ______(填“增大”、 “减小”或“不变”);
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用过滤的方法可分离碳酸钙和氯化钠溶液的混合物
B.为加快过滤,使用玻璃棒搅动漏斗里的液体
C.蒸发食盐水时,开始析出晶体后用玻璃棒搅拌
D.为加快蒸发的速度,可以加热至水全部蒸干得到晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:

(1)指出提取碘的过程中有关的实验操作名称:
①____________;写出过程②中有关反应的离子方程式: _________
(2)灼烧海带用到的仪器有_____________
(3)提取碘的过程中,可供选择的有机试剂是(____)
A .酒精 B .四氯化碳
C .甘油 D .醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
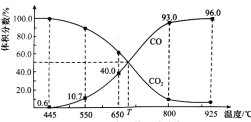
A. 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡不移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0p总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com