
【题目】已知某些化学键的键能数据如下:

(1)通过比较C—C 和 C=C 的键能大小,简要说明为什么烯烃易发生加成反应而烷烃不能?______ 。
(2)利用键能数据可判断反应 2H2 + O2 → 2 H2O 为 放热反应, 计算每生成 1 mol H2O 所放出的热量为_____________ kJ。
(3)若某有机物的结构简式如下: ![]() ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:________________
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:________________
(4)将硫酸铜白色固体溶于水得到蓝色的溶液,原因是生成了一种配合离子,其结构简式为: ___________(标明配位键),向该溶液中加入过量稀氨水得深蓝色溶液,其离子方程式为 _________ 。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是_________________________________。
【答案】C=C的健能<2C-C,说明π健易断裂,而δ健不易断裂 241 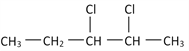
 [Cu(H2O)4]2++4NH3=[Cu(NH3)4]2++4H2O NF3分子中氟原子电负性强,吸电子,使氮原子上的孤对电子难于与Cu2+形成配位键
[Cu(H2O)4]2++4NH3=[Cu(NH3)4]2++4H2O NF3分子中氟原子电负性强,吸电子,使氮原子上的孤对电子难于与Cu2+形成配位键
【解析】
(1)根据化学键的键能数据可知,C=C的键能<2C-C,说明π键易断裂,而δ键不易断裂故烯烃易发生加成反应而烷烃不能;
(2)反应热=反应物总键能-生成物总键能,则反应 2H2 + O2 =2H2O △H=2mol×436kJ/mol+1mol×498kJ/mol-4mol×463kJ/mol =-482kJ/mol,每生成 1 mol H2O 所放出的热量为241kJ;
(3)若某有机物的结构简式如下: ![]() ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,分别为2,3-二氯戊烷和3,3-二氯戊烷,其中属于手性分子的物质为2,3-二氯戊烷,其结构简式为:
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,分别为2,3-二氯戊烷和3,3-二氯戊烷,其中属于手性分子的物质为2,3-二氯戊烷,其结构简式为: ;
;
(4)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,其结构简式为: ;生成此配合离子的离子方程式为:[Cu(H2O)4]2++4NH3=[Cu(NH3)4]2++4H2O;NF3分子中氟原子电负性强,吸引孤对电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键。
;生成此配合离子的离子方程式为:[Cu(H2O)4]2++4NH3=[Cu(NH3)4]2++4H2O;NF3分子中氟原子电负性强,吸引孤对电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图①②③④表示由不同化学元素组成的化合物,以下说法正确的是
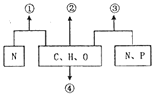
A. 若①为某生物大分子的组成单位,则①最可能是核苷酸
B. 若②是细胞中的储能物质,则②一定是脂肪
C. 若③是病毒的遗传物质,则③一定是RNA
D. 若④是植物细胞壁的主要成分,则④可能是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中正确的是( )
A.化学键存在于原子之间,也存在于分子之间
B.两个原子之间的相互作用叫做化学键
C.离子键是阴、阳离子之间的相互吸引力
D.化学键通常是指相邻的两个或多个原子之间强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诗词是中华民族灿烂文化的瑰宝。下列古诗中不涉及化学变化的是( )
A.忽如一夜春风来,千树万树梨花开
B.爆竹声中一岁除,春风送暖入屠苏
C.落红不是无情物,化作春泥更护花
D.春蚕到死丝方尽,蜡炬成灰泪始干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的溶液中,下列各组离子中能大量共存的是
A. K+、H+、SO42—、OH— B. Ba2+、K+、SO42—、NO3—
C. Na +、H+、Cl—、CO32- D. Na +、Cu2+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)短周期中可以做半导体材料的元素的最高价氧化物与烧碱溶液反应的离子方程式是:__________;
(2)为了提高煤的利用率,常将其气化或液化,其中一种液化是将气化得到的氢气和一氧化碳在催化剂作用下转化为甲醇,写出该化学反应方程式为____________;
(3)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是________反应(填“吸热”或“放热”)。

②在一定条件下,将2.5mol N2和7.5mol H2的混合气体充入体积为2L的固定闭容器中发生反应:N2(g)+ 3H2(g) ![]() 2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
(4)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:

A,B两个电极均由多孔的碳块组成。该电池的正极反应式为:________________;若将上述装置中的氢气换成甲烷,其余都不改变,对应装置的负极反应方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100℃ Cu(NO3)2 的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4 和Cu(OH)2 反应制备 Cu2O 的热化学方程式为 ________________________。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
(1)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是(_______)
CH3OH(g)已达平衡状态的是(_______)
A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2 和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2 的转化率将 ______(填“增大”、 “减小”或“不变”);
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。关于该实验的说法不正确的是
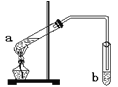
A. a试管中发生的反应是酯化反应,原理是乙酸脱去羟基、乙醇脱氢
B. b试管中所盛的试剂是NaOH
C. 反应后b中可以看到明显的分层,产物在上层
D. 试管b中的导管要在液面的稍上方,不能插入液面以下,是为了防止倒吸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com