
【题目】已知液氨能和NaH反应放出H2:NaH + NH3 =NaNH2 + H2↑,它也能和Na反应放出H2。据此下列说法中错误的是( )
A. 液氨和NaH反应中,液氨是氧化剂
B. 液氨和NaH反应生成的H2既是氧化产物又是还原产物
C. 液氨和Na反应产物中有NaNH2
D. 液氨和NaH或Na反应都属于置换反应
【答案】D
【解析】NH3中N元素的化合价为-3价,H元素的化合价为+1价;NaH中H元素的化合价为-1价;用双线桥分析反应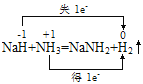 ,对照氧化还原反应中的概念作答;Na与液氨发生置换反应生成NaNH2和H2。
,对照氧化还原反应中的概念作答;Na与液氨发生置换反应生成NaNH2和H2。
NH3中N元素的化合价为-3价,H元素的化合价为+1价;NaH中H元素的化合价为-1价;用双线桥分析反应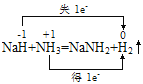 。A项,NH3中+1价的H降至0价,液氨是氧化剂,A项正确;B项,H2中0价H部分由-1价H氧化得到、部分由+1价H还原得到,H2既是氧化产物又是还原产物,B项正确;C项,根据题意“液氨能与Na反应放出H2”,Na与液氨反应的化学方程式为2Na+2NH3=2NaNH2+H2↑,C项正确;D项,液氨与NaH的反应中反应物没有单质,液氨与NaH的反应不是置换反应,液氨与Na的反应为置换反应,D项错误;答案选D。
。A项,NH3中+1价的H降至0价,液氨是氧化剂,A项正确;B项,H2中0价H部分由-1价H氧化得到、部分由+1价H还原得到,H2既是氧化产物又是还原产物,B项正确;C项,根据题意“液氨能与Na反应放出H2”,Na与液氨反应的化学方程式为2Na+2NH3=2NaNH2+H2↑,C项正确;D项,液氨与NaH的反应中反应物没有单质,液氨与NaH的反应不是置换反应,液氨与Na的反应为置换反应,D项错误;答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 加入CH3OH的物质的量a=1.64
B. 此时刻正反应速率大于逆反应速率
C. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率减小
D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
实验2 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 | |
ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-![]() I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-![]() I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图的能量图,下列说法正确的是:
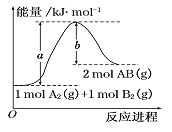
A. A2(g) + B2(g) = 2AB(g) 是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 2AB(g) = A2(l) + B2(l) △H<(b-a)kJ/mo1
D. 1molA2(g)和1molB2(g)的能量之和为akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ | ⑩ |
(1)写出下列元素的元素符号:① _____ ②_____ ⑩_____
(2)在这些元素中,最活泼的金属元素是_____,最不活泼的元素是_____。
(3)这些元素的最高价氧化物对应水化物中,具有两性的是__________,它在水中的电离方程式为______________________________________________/span>
(4)将元素⑤、⑨和⑩的简单离子按半径由大到小排序____________________
(5)在③与④的单质中,化学性质较活泼的是____,写出一个可以验证该结论的化学事实______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能使反应速率加快,下列叙述正确的是( )
A. 降低反应所需的活化能
B. 使反应体系的活化分子百分数增大
C. 体系中活化分子总数不变
D. 对于吸热反应、放热反应,反应速率同等程度加大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中前四周期的部分元素,表中所列的字母分别代表一种化学元素,根据要求回答下列各小题:
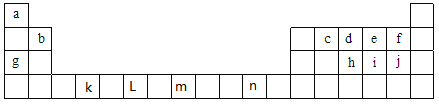
(1)①元素非金属性强弱比较有很多方法,其中f和j的非金属性强弱的研究方案中不可行的是_________(填序号)
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较电负性 e.比较最高价氧化物对应水合物的酸性
②根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有_______种,属于d区的元素有_______种;元素n属于________区。
③在c、d、e三种元素中,电负性由小到大的顺序是______________,第一电离能由大到小的顺序是____________(用元素符号回答)。
(2)①写出 n2+的核外电子排布式:______________________。
②写出k元素基态原子的价电子排布式:_____________。
③写出 L元素基态原子的外围电子排布式:_____________。
④写出m元素基态原子价电子的轨道表示式:________________________,该元素在元素周期表中的位置为:__________________________。
⑤j简单阴离子的结构示意图为____________。
(3)①元素i的氢化物分子属于____________(填“极性”或“非极性”)分子,其分子的空间构型为____________,该氢化物分子中i原子轨道的杂化类型是__________; 由i与e形成的ie42-离子,其空间构型为__________(用文字描述)。
②已知cd- 与 d2 结构相似,1 mol cd- 中![]() 键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
③f2通入稀NaOH溶液中可生成Of2,Of2分子构型为___________,其中氧原子的杂化方式为_______;
④化合物j2e的立体构型为_________,中心原子的价层电子对数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com