
科目:高中化学 来源: 题型:

|

| 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| △ |
| 电解 |
| 2800℃ |
| △ |
| C |
| 还原 |
| HCl |
| ||
| 714℃ |
| HCl |
| 活泼金属 |
| 还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源:湖北省孝感高级中学2011-2012学年高二上学期期中考试化学试题 题型:038
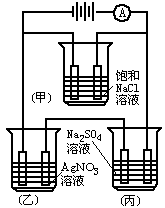
如图为某电解装置,均用铂作电极,测得电流强度l=5.5 A通电7.3 h后,在丙容器中使100 g 14.0%的硫酸钠溶液电解得到气体总体积(标准状况下)为16.8 L,没有析出晶体.请回答:

(1)通电7.3 h后,丙容器溶液中溶质的质量分数.(溶剂挥发忽略不计,必须写出相关化学方程式及计算过程)
(2)乙容器中,阴极得到银的质量为________.
(3)甲容器放入50 L NaC1溶液(设电解后溶液的体积不变).电解后溶液的pH是多少?(已知1 mol电子所带的电量为96500 C)(必须写出相关化学方程式及计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com