
【题目】下列说法不正确的是
A. Na2O2可用于呼吸面具中氧气的来源
B. Na2O和Na2O2投入水中都能生成NaOH,它们都是碱性氧化物
C. NaHCO3可用于治疗胃酸过多,制造发酵粉等
D. 可用洁净的铁丝代替铂丝进行焰色反应
科目:高中化学 来源: 题型:
【题目】下列变化过程中,⊿S<0的是: ( )
A.干冰的升华B.NH3 (g) +HCl (g) =NH4Cl (s)
C.氯化钠溶于水中D.CaCO3 (s) 分解为CaO (s) 和CO2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
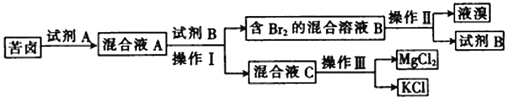
回答下列问题:
(1)若试剂A是一种有色气体单质,则A是_______(填化学式);
(2)“操作II”是_______,“操作III”是_______。(填字母)
a.蒸发 b.蒸馏 c.分液 d.重结晶
(3)试剂B可能是下列物质中的________。(填字母)
a.饱和NaCl溶液 b.CCl4 c.NaOH d.乙醇
Ⅱ.一种工业制备SrCl2·6H2O的生产流程如下图所示:

已知:①M(SrCl2·6H2O)=267g·mol-1;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)加入硫酸溶液的目的是______________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol·L1 (注:此时滤液中Ba2+浓度为1×105 mol·L1)。
(2)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×102 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_______(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】众多西药均是借助有机合成得出,现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是

A. 该有机物能与NaHCO3发生反应
B. 该有机物与浓硫酸混合加热可发生消去反应
C. 1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D. 该有机物经催化氧化后能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

实验步骤:
在A中加入4.4 g异戊醇(3-甲基-1-戊醇)、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的具体名称是____________,实验时冷却水的进水口是_____(a或b)。
(2)在洗涤操作中,先水洗再饱和NaHCO3溶液洗而不是直接用饱和NaHCO3溶液洗涤的原因是____________________。
(3)该制备反应的化学反应方程式为__________________________。
(4)本实验中加入过量乙酸的目的是___________________________。
(5)本实验中不能用生石灰代替无水MgSO4的原因________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是___________(填标号)。

(7)本实验的产率是___________(填标号)。
a.90% b.60% c.40% d.30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:

已知:a.NiCl2易溶于水,Fe3+不能氧化Ni2+。
b.某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
Fe(OH)3 | 3.9×10-38 | 2.53 | 2.94 |
Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据表中数据判断步骤②依次析出的沉淀Ⅱ______和沉淀Ⅲ______(填化学式),则pH1___pH2(填“>”、“=”或“<”),控制两种沉淀析出可利用______(填序号)。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4H2O>NiC2O42H2O,则步骤③的化学方程式是______。步骤③后,过滤沉淀所需的玻璃仪器有_____________________。
(3)试写出步骤⑥的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国最新战机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应:TiCl4+2Mg==Ti+2MgCl2,下列有关该反应的说法正确的是()

A. TiCl4是还原剂
B. Mg得到电子
C. TiCl4发生氧化反应
D. Mg被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com