
【题目】氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。
(1) 请补充空白并配平化学方程式。
____KClO3+____HCl(浓) → ____KCl+____ClO2↑+____Cl2↑+ ___
(2) 浓盐酸在反应中显示出来的性质是________(填序号)
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为________。
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的______倍。
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:___________________________________。
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
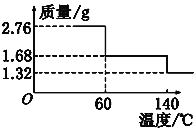
①试确定60 ℃时CaO2·xH2O中x=________。
②该样品中CaO2的质量分数为________。(保留一位小数)
【答案】2 4 2 2 1 2H2O B 0.4mol 2.5 CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl 2 26.09%
【解析】
(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2,其反应方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O;
(2)反应2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O中,HCl中氯元素化合价由1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各有一半,故选B;
(3)若反应中生成标准状况下13.44L气体,即生成13.44L÷22.4L/mol=0.6mol的气体,因为生成二氧化氯和氯气的物质的量之比为1:2,所以分别生成0.2mol二氧化氯和0.4mol氯气,则消耗还原剂的物质的量为0.4mol;
(4)1molH2O2可以得到2mol电子,1molClO2可以得到5mol电子,ClO2消毒的效率是过氧化氢的![]() ;
;
(5)通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,反应的化学方程式为CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl
①由图中可看出,140℃以后,结晶水全部脱去,脱去的水的质量为2.76g-1.32g=1.44g,故水的物质的量为0.08mol,CaO2·8H2O的物质的量为0.01mol,由曲线图可看出,60-140℃失去结晶水的质量为1.68g-1.32g=0.36g,物质的量为0.02mol,则x=2;
②过氧化钙的质量为0.01mol×72g·mol-1=0.72g,故该样品中过氧化钙的质量分数为![]() ×100%=26.09%。
×100%=26.09%。


科目:高中化学 来源: 题型:
【题目】某温度下,在一容积固定的容器中,反应aA(g)+bB(g)![]() hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
A.平衡不移动B.混合气体的密度不变
C.B的体积分数减少D.amol/L<c(A)<2amol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2═NH4BO2+4H2O。已知两极室中电解质足量,下列说法错误的是( )
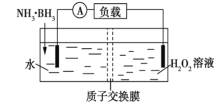
A. 正极的电极反应式为3H2O2+6H++6![]() ═6H2O
═6H2O
B. 电池工作时,H+通过质子交换膜从右向左移动
C. 电池工作时,两电极均不会产生气体
D. 工作一段时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
A.混合气体的压强B.混合气体的平均相对分子质量
C.A的物质的量D.B的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型药物,具有血管扩张活性的选择性β1肾上腺素受体拮抗剂,用于合成该药物的中间体G的部分流程如下:
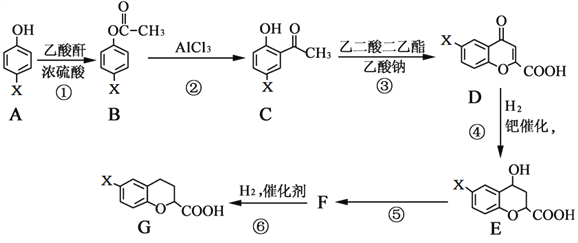
已知:乙酸酐的结构简式为:![]()
请回答下列问题:
(1)G物质中的含氧官能团的名称是________、________。
(2)反应A→B的化学方程式为_________________________________________。
(3)上述④、⑤变化过程的反应类型分别是_______________、______________。
(4)有机物F的结构简式为______________________。
(5)写出满足下列条件的C的同分异构体的结构简式:___________、___________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(6)根据已有知识并结合相关信息,补充完成以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。部分合成路线流程图如下:
的合成路线流程图(无机试剂任选)。部分合成路线流程图如下:

请完成合成路线_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①铅蓄电池总反应为: Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列关于电池的叙述正确的是
A.充电电池的化学反应原理是氧化还原反应
B.铅蓄电池可以无限制地反复放电、充电,不会造成环境污染
C.铅蓄电池比锂电池的理论比能量高
D.铅蓄电池正极电极反应为:PbO2 +4H+ +2e— = Pb2+ +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2L甲醛气体与xL的氧气混合点燃,反应后甲醛和氧气均无剩余,生成的混合气体的体积为aL(气体体积均在120°C,101kPa时测定),并将此aL混合气体通过足量的碱石灰后,测得剩余气体的体积为bL。若a-b=3.5,则x的值为
A. 2B. 4C. 1.75D. 3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应的离子方程式对应且正确的是 ( )
A. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B. 用醋酸除去水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
C. 苯酚与纯碱溶液混合:2C6H5OH + CO32- ![]() CO2 ↑+ H2O + 2C6H5O-
CO2 ↑+ H2O + 2C6H5O-
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4Ag(NH3)2++4OH-![]() CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷既是重要的能源也是重要的化工原料。
已知反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
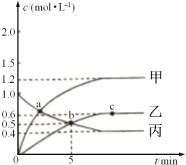
(1)容器体积V=_____L。
(2)图中表示H2O的物质的量浓度与时间关系的是曲线_____(填“甲”“乙"或"丙")。
(3)0~5min内,用N2表示的化学反应速率为_____mol·L-1·min-1。
(4)a、b、c三点中达到平衡的点是______。达到平衡时,NO2的转化率是_____。(物质平衡转化率=转化的物质的量/起始的物质的量×100%)。
(5)a点时,n(CH4):n(NO2)=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com