
【题目】甲烷既是重要的能源也是重要的化工原料。
已知反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
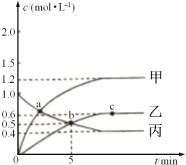
(1)容器体积V=_____L。
(2)图中表示H2O的物质的量浓度与时间关系的是曲线_____(填“甲”“乙"或"丙")。
(3)0~5min内,用N2表示的化学反应速率为_____mol·L-1·min-1。
(4)a、b、c三点中达到平衡的点是______。达到平衡时,NO2的转化率是_____。(物质平衡转化率=转化的物质的量/起始的物质的量×100%)。
(5)a点时,n(CH4):n(NO2)=_____。
【答案】2 甲 0.1 c 80%或0.8 4:5
【解析】
(1)有甲烷的物质的量和浓度可以求得容器的体积;
(2)N2、H2O的化学计量数之比是1:2,可以推出水的物质的量浓度与时间关系的曲线;
(3)化学反应速率等于浓度的变化量除以时间;
(4)可逆反应达到平衡时反应物和生成物的浓度不变,物质平衡转化率=转化的物质的量/起始的物质的量×100%;
(5)a点时,甲曲线和丙曲线的浓度相等,即是物质的量相等,利用方程式进行计算。
(1)向体积为V的恒容密闭容器中通入2molCH4,从图中知道甲烷的起始物质的量浓度是1.0mol/L,得出容器体积V=2L,故答案为:2;
(2)甲,乙曲线是生成物的浓度变化量,氮气和水的化学计量数之比是1:2,可以推出甲曲线是H2O的物质的量浓度与时间关系的曲线,故答案为:甲;
(3)N2的化学反应速率为![]() =
=![]() 0.1 mol·L-1·min-1,故答案为:0.1;
0.1 mol·L-1·min-1,故答案为:0.1;
(4)可逆反应达到平衡时各物质的浓度保持不变,c点时乙曲线的浓度保持不变,是平衡点,达到平衡时,生成氮气的物质的量浓度是0.6mol/L,容积的体积是2L,即是氮气的物质的量是1.2mol,消耗二氧化氮2.4mol,NO2的转化率是![]() ×100%= 80%,故答案为:c;80%或0.8;
×100%= 80%,故答案为:c;80%或0.8;
(5)a点时,设水的物质的量是2xmol,有方程式可知消耗甲烷的物质的量xmol,剩余甲烷的物质的量是(2-x)mol,由于甲烷的浓度等于水的浓度,可知甲烷的物质的量等于水的物质的量,即2x=2-x,解得x=2/3mol,消耗二氧化氮的物质的量是4/3mol,剩余甲烷的物质的量是2-x=2-2/3mol=4/3mol,剩余二氧化氮的物质的量是3-2x=3-4/3mol=5/3mol,n(CH4):n(NO2)=4/3mol:5/3mol=4:5,故答案为:4:5。


科目:高中化学 来源: 题型:
【题目】氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。
(1) 请补充空白并配平化学方程式。
____KClO3+____HCl(浓) → ____KCl+____ClO2↑+____Cl2↑+ ___
(2) 浓盐酸在反应中显示出来的性质是________(填序号)
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为________。
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的______倍。
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:___________________________________。
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
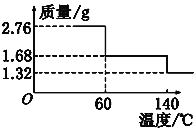
①试确定60 ℃时CaO2·xH2O中x=________。
②该样品中CaO2的质量分数为________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 水合铜离子的模型如图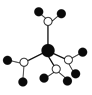 ,1个水合铜离子中有4个配位键
,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图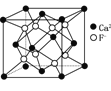 ,每个CaF2晶胞平均占有4个Ca2+
,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图 ,H原子核外大多数电子在原子核附近运动
,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图 ,为面心立方最密堆积,每个Cu原子的配位数均为12
,为面心立方最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283kJ/mol,则CO的燃烧热的热化学方程式为____。
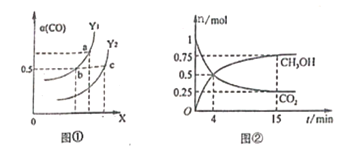
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) H=-116kJ/mol,如图①表示CO的平衡转化率(
CH3OH(g) H=-116kJ/mol,如图①表示CO的平衡转化率(![]() )随温度和压强变化的示意图中横坐标X表示的是_________,Y1______Y2(填“<”、“=”、“>”);
)随温度和压强变化的示意图中横坐标X表示的是_________,Y1______Y2(填“<”、“=”、“>”);
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在0.5L的密闭器中,充入1 mol CO2和3molH2,在500℃下生反应,测得CO2(g和CH3OH(g)的量随时间变化如图②所示。
CH3OH(g)+H2O(g),在0.5L的密闭器中,充入1 mol CO2和3molH2,在500℃下生反应,测得CO2(g和CH3OH(g)的量随时间变化如图②所示。
①反应进行到4min时,v(正)____v(逆)(填“<”、“=”、“>”),0~4min,H2的平均反应速率v(H2)=_____________;
②该温度下平衡常数为_____________;
③下列能说明该反应已达到平衡状态的是___________;
A. v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲醇为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极写出该燃料电池的负极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃甲酸(![]() )俗名糠酸,其在塑料工业中可用作增塑剂、热固性树脂等。呋喃甲酸可由呋喃甲醛制备,其制备原理如下所示:
)俗名糠酸,其在塑料工业中可用作增塑剂、热固性树脂等。呋喃甲酸可由呋喃甲醛制备,其制备原理如下所示:
反应1: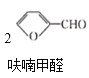 +NaOH→
+NaOH→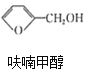 +
+![]() ;
;
反应2:![]() +HCl→
+HCl→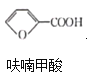 +NaCl;
+NaCl;
已知:I、反应1是放热反应;
II、乙醚的沸点是34.6℃,易挥发,遇明火易燃,其蒸气可使人失去知觉;
III、呋喃甲酸的溶解度随温度的升高而升高,且升温过程中溶解度变化较大;
实验步骤:向三颈烧瓶中加入16.4mL(约0.2mol)呋喃甲醛按以下流程图制备并获得粗品,粗品进一步提纯得到精产品9.5g
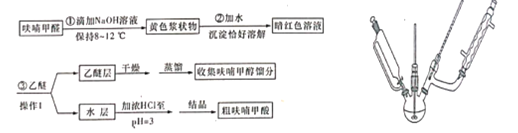
(1)若用如上图装置作为反应1的发生装置图中有一处明显错误的地方是________。
(2)步骤①中,为控制反应温度在8~12℃,可采取的措施有①____________;②________。
(3)操作1的名称为__________,要用到的玻璃仪器有______。
(4)在对乙醚层进行分离时,用下图中的_______(填字母代号)装置更好,与另一装置相比,该装置具有以下优点:
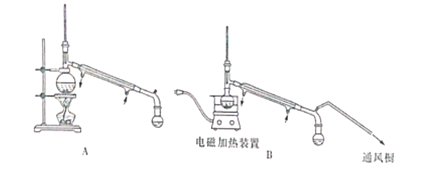
①______________;②___________。
(5)经过结晶得到的粗呋喃甲酸若要进一步提纯,要经过热水溶解→活性炭脱色→蒸发→浓缩→_______→______→抽滤→洗涤→干燥。
(6)呋喃甲酸的产率为______(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为________,所含非金属元素的第一电离能由大到小的顺序是_________。
(3)尿素分子中碳原子为________杂化,分子中σ键与π键的数目之比为_____。
(4)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20 .5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。
(5)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示。
吡咯![]() 血红素
血红素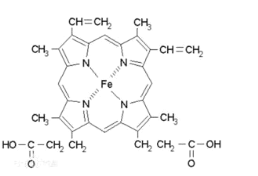
①1 mol吡咯分子中所含的σ键总数为____个。(用NA表示阿伏加德罗常数的值)分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____ 。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____ 。
②血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过____键相结合。
③血红素中N的杂化方式为______________,请画出血红素中N与Fe的配位键_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化镁晶体具有如下转化关系:

下列说法错误的是
A.固体I可溶于饱和NH4Cl溶液
B.气体I能使无水CuSO4变蓝色
C.溶液I和溶液Ⅱ常温下均能与Cu反应
D.在固体Ⅱ的浊液中加入KI溶液可产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | _____ | _____ | _____ | _____ |
①CH(CH3)3和CH3CH2CH(CH3)2
②C(CH3)4和CH3CH2CH(CH3)2
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥12C、13C、14C
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑧臭氧(18O3)和氧气(16O18O )
⑨ 和
和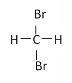
⑩ H216O和H218O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com