
【题目】下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | _____ | _____ | _____ | _____ |
①CH(CH3)3和CH3CH2CH(CH3)2
②C(CH3)4和CH3CH2CH(CH3)2
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥12C、13C、14C
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑧臭氧(18O3)和氧气(16O18O )
⑨ 和
和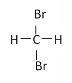
⑩ H216O和H218O
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】甲烷既是重要的能源也是重要的化工原料。
已知反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
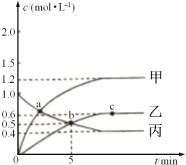
(1)容器体积V=_____L。
(2)图中表示H2O的物质的量浓度与时间关系的是曲线_____(填“甲”“乙"或"丙")。
(3)0~5min内,用N2表示的化学反应速率为_____mol·L-1·min-1。
(4)a、b、c三点中达到平衡的点是______。达到平衡时,NO2的转化率是_____。(物质平衡转化率=转化的物质的量/起始的物质的量×100%)。
(5)a点时,n(CH4):n(NO2)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET俗称涤纶树脂,是一种热塑性聚酯;PMMA俗称有机玻璃。工业上以基础化工原料合成这两种高分子材料的路线如下:
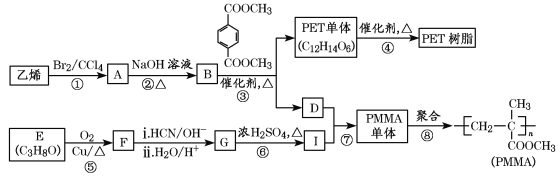
已知:Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烃基)
RCOOR″+R′OH(R、R′、R″代表烃基)
II、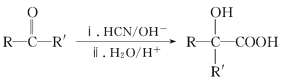 (R、R′、代表烃基)
(R、R′、代表烃基)
(1)指出下列反应的反应类型:反应③_________;反应⑥______。
(2)B的名称为_______;
反应②的化学方程式为____________________________。
反应⑤的化学方程式为____________________________。
(3)PET单体(C12H14O6)的结构简式为_______。
(4)下列说法正确的是________(填字母)。
a.B和D互为同系物
b.⑧为加聚反应
c.F和丙醛互为同分异构体
d.G能发生加成反应和酯化反应
(5)I的同分异构体中,满足下列条件的有___________种。(不包括I)
①能与NaOH溶液反应;②含有碳碳双键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列关于该有机物的说法正确的是
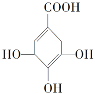
A.分子式为C7H6O5
B.分子中含有两种官能团
C.该物质能发生加成反应,氧化反应和取代反应
D.在水溶液中羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____。
(3)铁氰化钾 K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____。
④铁氰化钾中,不存在___(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号![]() 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为![]() ),则
),则![]() 中的大Π键应表示为____,其中碳原子的杂化方式为____。
中的大Π键应表示为____,其中碳原子的杂化方式为____。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
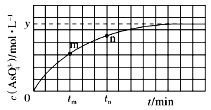
A. 溶液的pH不再变化
B. 2v正(I-)=v逆(AsO33-)
C. c(AsO43-)/c(AsO33-)不再变化
D. c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛合金材料在航海航天等工业有十分重要的用途。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图所示。

请回答下列问题:
(1)步骤①发生氧化还原反应,其氧化剂是___________。
(2)步骤②中发生的化学反应方程式为____________________________________________。
(3)步骤③需在氩气环境中进行,目的是__________________________________________。
(4)金属钛中常混有少量镁,提纯时可用稀硫酸除去少量的镁,其理由是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室选用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素:
实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
(1)配平反应原理离子方程式:
___MnO4-+ __H2C2O4+___→___Mn2++ ___CO2↑+____H2O
(2)探究影响化学反应速率的因素
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
a.探究温度对化学反应速率影响的实验编号是_______(填编号,下同),探究反应物浓度对化学反应速率影响的实验编号是_______。
b.混合液褪色时间由大到小的顺序是_____________。
c.测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图所示,请解释“n(Mn2+)在反应起始时变化不大,一段时间后快速增大”的主要原因:_______。

Ⅱ. 用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。
实验步骤:准确取1 g Na2C2O4样品,配成
(3)高锰酸钾溶液应装在____滴定管中。(填“酸式”或“碱式”)
(4)滴定至终点时的实验现象是:_________。
(5)计算样品中Na2C2O4的纯度是______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器B的名称为________,干燥管D的作用为________。
(2)若要证明非金属性;![]() ,则A中加浓盐酸,B中加
,则A中加浓盐酸,B中加![]() ,(
,(![]() 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,C溶液中的离子方程式为________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,C溶液中的离子方程式为________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(3)若要证明非金属性:![]() ,则在A中加盐酸,B中加
,则在A中加盐酸,B中加![]() ,C中加________(写化学式)溶液,若观察到C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶。
,C中加________(写化学式)溶液,若观察到C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com