
【题目】根据图示填空

(1)化合物A中含氧官能团的名称是___________________________________。
(2)1mol A与2 mol H2反应生成1 mol E,其反应方程式是__________________________________。
(3)写出A发生加聚反应化学方程式____________________________。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是_________________________。写出D与NaOH溶液反应的化学方程式_________________________________________。
(5)F的结构简式是______________。
(6)写出E发生缩聚反应的化学方程式___________________________________。
【答案】醛基、羧基 OHC-CH=CH-COOH+2H2![]() HO-CH2-CH2-CH2-COOH n OHC-CH=CH-COOH
HO-CH2-CH2-CH2-COOH n OHC-CH=CH-COOH![]()
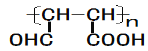
![]()
![]() +4NaOH
+4NaOH ![]()
![]() +2NaBr+2H2O。
+2NaBr+2H2O。 ![]() 或
或![]() n HOCH2-CH2-CH2-COOH
n HOCH2-CH2-CH2-COOH![]() (n-1)H2O+
(n-1)H2O+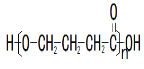
【解析】
A能和碳酸氢钠反应,说明含有羧基,能和银氨溶液反应说明含有醛基,产物B能和溴发生反应,D不含支链,说明A中含有碳碳双键,不含支链。从F的分子式分析,A的结构简式为CHOCH=CHCOOH, C为CHOCH=CHCOONa, E为CH2OHCH2CH2COOH。
A能和碳酸氢钠反应,说明含有羧基,能和银氨溶液反应说明含有醛基,产物B能和溴发生反应,D不含支链,说明A中含有碳碳双键,不含支链。从F的分子式分析,A的结构简式为CHOCH=CHCOOH, C为CHOCH=CHCOONa, E为CH2OHCH2CH2COOH。(1)化合物A含有醛基、羧基;
(2)1molA和2mol氢气反应的方程式为:
OHC-CH=CH-COOH+2H2![]() HO-CH2-CH2-CH2-COOH
HO-CH2-CH2-CH2-COOH
(3)A含有碳碳双键,能发生加聚反应,方程式为:
n OHC-CH=CH-COOH![]()
 ;
;
(4)A发生银镜反应后在酸性条件下得到B的结构简式为COOHCH=CHCOOH,在酸性条件下与溴反应生成D,D的结构简式为 ![]() ; D和氢氧化钠反应的化学方程式为:
; D和氢氧化钠反应的化学方程式为:![]() +4NaOH
+4NaOH ![]()
![]() +2NaBr+2H2O。
+2NaBr+2H2O。
(5)F的结构中含有环,且有酯基,结构简式为![]() 或
或![]() ;
;
(6). E的结构中含有羧基和羟基,所以能发生缩聚反应,方程式为:
n HOCH2-CH2-CH2-COOH![]() (n-1)H2O+
(n-1)H2O+![]() 。
。


科目:高中化学 来源: 题型:
【题目】关于下列电化学装置说法正确的是

A. 装置①中,构成电解池时Fe极质量既可增也可减
B. 装置②工作一段时间后,a极附近溶液的pH减小
C. 用装置③精炼铜时,d极为精铜
D. 装置④中电子由Fe经导线流向Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2。下列分析不正确的是

A. 推测青蒿素在乙醚中的溶解度小于在水中的溶解度
B. 通过元素分析与质谱法可确认青蒿素的分子式
C. 青蒿素中含有的 “![]() ” 基团是酯基
” 基团是酯基
D. 青蒿素中对热不稳定且具有氧化性的基团是“—O—O—”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)![]() 2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )

A. 点a的正反应速率比点b的大
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理加以解释的是
A. 夏天,打开啤酒瓶时会在瓶口逸出气体
B. 浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C. 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D. 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,充入时体积如图所示,若将装置右边H2、O2的混合气体点燃引爆,活塞先左弹,恢复至原温度后,活塞右滑最终停在容器的正中央,则原来H2、O2的体积比最接近于( )

①2∶7 ②5∶4 ③4∶5 ④7∶2
A. ①② B. ②④ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO![]() Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A. 该生产石墨烯的反应属于氧化还原反应
B. 石墨烯与金刚石互为同素异形体
C. Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D. 自然界中碳元素有游离态和化合态两种存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一未知浓度的NaOH溶液,某兴趣小组打算用已知浓度的稀硫酸来确定该NaOH溶液的浓度,现进行如下实验,请按要求完成题中填空。
步骤一:配制240mL 1.00mol/L的H2SO4标准溶液
相关操作:①计算;②量取;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(1)现用98%的浓硫酸(密度约为1.8g/cm3)来配制,需用量筒量取浓硫酸的体积为_____。
(2)实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒、_____________、_______________。
(3)下列操作中会引起所配稀硫酸浓度偏大的操作有_______________。(填字母)
A.用量筒量取浓硫酸时,俯视读数
B.从量筒中倒出量取的浓硫酸后洗涤量筒内壁并把洗涤液转入容量瓶中
C.稀释浓硫酸时有少量液体溅出
D.浓硫酸稀释后未冷却就立即转移到容量瓶中
E.容量瓶中残留少量水即用来配溶液
F.定容摇匀后,发现液面低于刻度线
(4)简述上述配溶液时步骤⑤定容时的操作______________________________________。
步骤二:滴定
相关操作:取20.00mL待测NaOH溶液,向其中滴加步骤一配制的1.00mol/L H2SO4标准溶液,通过某种手段确定恰好完全反应时消耗H2SO4标准溶液15.00mL。
(5)通过实验确定该待测NaOH溶液的浓度为_____________(结果保留两位小数)。
(6)若因为操作不当造成步骤一配制的H2SO4标准溶液浓度偏大,但正常进行步骤二的操作,则导致测得的NaOH溶液的浓度比实际_______。(填“偏大”、“偏小”、“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. O2、O3互为同位素B. 1H、2H、3H是三种核素
C. 32He和42He互为同素异形体D. H2O与D2O的组成元素不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com